 |
Опыт 8. Восстановление дихромата калия
|
|
|
|
Опыт 8. Восстановление дихромата калия
Выполнение работы. К раствору хлорида олова (II) добавить 1–3 капли
2 н. хлороводородной кислоты. К подкисленному раствору по каплям прибавлять дихромат калия (2–3 капли). Наблюдать появление зеленой окраски вследствие восстановления иона в ион Сr3+. Написать уравнение протекающей реакции.
Лабораторная работа № 4
Коррозия металлов
Приборы и реактивы: стеклянные пробирки, стеклянные палочки.
Сухие вещества: пластинки оцинкованного железа, пластинки луженого железа, пластинки стали.
Растворы: фенолфталеина; серной кислоты (2 н. ); гексацианоферра-
та (III) калия (0, 5 н. ); хлорида натрия (3 %).
Опыт 1. Качественная реакция на ион Fe2+
При коррозии металлического железа его атомы теряют электроны и превращаются в ионы двухвалентного железа Fe2+. Присутствие в системе с корродирующим железом ионов Fe2+ определяют по характерной синей окраске турнбулевой сини, образующейся по реакции:
3FeSO4 + 2K3[Fe(CN)6] ® Fe3[Fe(CN)6]2 + 3K2SO4
3Fe2+ + 2[Fe(CN)6]3- ® Fe3[Fe(CN)6]2.
турнбулева синь
Опыт 2. Коррозия оцинкованного (Fe-Zn)
и луженого (Fe-Sn) железа в кислой среде
Выполнение работы. В две пробирки налить на ½ их объема дистиллированной воды, добавить в каждую по 3 капли 2 н. раствора серной кислоты и по 2 капли раствора К3[Fe(CN)6].
Поместить в пробирки пластинки оцинкованного и луженого железа. Через несколько минут пронаблюдать появление синего окрашивания в одной из пробирок (в какой именно? ).
Запись данных опыта. Описать наблюдаемые явления и ответить на поставленные вопросы. Составить схемы гальванических элементов, образую-щихся при повреждении защитного покрытия на оцинкованном и луженом железе. Пользуясь значениями стандартных электродных потенциалов, опре-делить анод и катод в каждом из гальванических элементов.
|
|
|
Составить уравнение анодного процесса и процесса катодной деполя-ризации. Какой вид электрохимической коррозии наблюдается? Какой металл выполняет роль анодного, какой – катодного защитного покрытия по отно-шению к железу?
Какой металл будет разрушаться первым в процессе коррозии в следующих парах: алюминий – медь, медь – никель, железо – никель?
Опыт 3. Коррозия железа под каплей жидкости
Выполнение работы. В пробирке приготовить смесь из 10 капель
3%-го раствора NaCl, 1 капли раствора красной кровяной соли К3[Fe(CN)6] и
1 капли раствора индикатора фенолфталеина. Одну каплю полученной смеси
наносят пипеткой на стальную пластинку. Через некоторое время наблюдают появление синей осадка турнбулевой сини в центре пятна под каплей и малинового окрашивания фенолфталеина по краям (рис. 1).
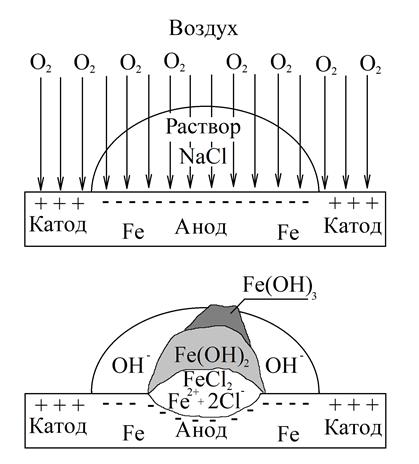
Рис. 1. Коррозия под каплей жидкости
Запись данных опыта. Почему анодная зона образуется в центре капли, а по краям ее возникает катодная зона? Можно ли это объяснить неравномерным доступом кислорода воздуха к разным участкам железа под каплей?
Описать наблюдаемые явления и ответить на поставленные вопросы. Дать схему перехода электронов при коррозии железа под каплей жидкости. Написать электронные уравнения электродных процессов и суммарное уравнение химической реакции.
Лабораторная работа № 5
Гидролиз солей
Приборы и реактивы: пипетки на 1 мл, мерная стеклянная колба на 100 мл, стеклянные пробирки, стеклянные палочки.
Растворы: хлорида аммония (0, 1 М), хлорида алюминия (0, 1 М), сульфата меди (0, 1 М), бикарбоната натрия (0, 1 М).
Определение константы и степени гидролиза солей
|
|
|
измерением pН раствора
Выполнение работы. Определить константу и степень гидролиза одной из солей: хлорида аммония, хлорида алюминия, сульфата меди и бикарбоната натрия в 0, 1 М растворах и на основании полученных данных сделать вывод об их зависимости от концентрации.
Получить у преподавателя пробирку с 0, 1 М раствором одной из вышеперечисленных солей и рН этого раствора. Затем приготовить 0, 001 М раствор соли. Для этого пипетку на 1 мл ополоснуть 0, 1 М раствором соли, после чего отмерить ею 1 мл этого раствора и внести в колбу вместимостью 100 мл. Довести объем раствора до метки на колбе дистиллированной водой, закрыть колбу пробкой и тщательно перемешать раствор, переворачивая колбу несколько раз вверх дном. Определить рН приготовленного 0, 001 М раствора соли тем же методом, каким было сделано первое определение.
Запись данных опыта. Записать значения рН, экспериментально най-денные в 0, 1 М и в 0, 001 М растворах солей. Вычислить константы гидролиза соли Кгидр по найденным значениям рН.
Например, в соответствии с уравнением гидролиза NH4Cl
NH4+ + H2O « NH3× H2O + H+
константа гидролиза вычисляется как

Из уравнения гидролиза видно, что [NH3× H2O] = [Н+]. Вследствие практически полной диссоциации солей в растворе при небольших значениях степени гидролиза равновесная концентрация иона NH4+ мало отличается от начальной, то есть можно принять, что [NH4+]равн = Ссоли. Тогда получаем расчетную формулу

Концентрация соли Ссоли в растворах известна (0, 1 М и 0, 001 М), а концентрацию ионов Н+ вычислить для каждого случая по найденным экспериментально значениям рН. Степень гидролиза h связана с константой гидролиза соли уравнением

откуда

Вычислить по этой формуле степень гидролиза каждой соли в обоих исследованных растворах.
Сравнить экспериментальные значения Кгидр и h в 0, 1 М и 0, 001 М рас-творах солей с рассчитанными. Сделать вывод о влиянии концентрации соли (разбавления раствора) на константу и степень гидролиза солей при неизменной температуре. Будет ли изменяться Кгидр при повышении температуры? Почему?
|
|
|


