 |
Примеры решения типовых задач.
|
|
|
|
1. Рассчитать, пользуясь таблицей термодинамических свойства простых веществ и соединений (Приложение 9), тепловой эффект химической реакции
4NH3 + 5О2 = 4NO + 6H2O
при р = 1 атм, Т = 298 К. Все реагенты и продукты – газы.
Решение:


2. Рассчитать, пользуясь таблицей термодинамических величин, стандартное изменение энтальпии  и внутренней энергии
и внутренней энергии 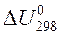 в химической реакции:
в химической реакции:
2Cl2(г) + 2Н2О(г) = 4HCl(г) + О2(г)
Решение:
D U = D H – D nRT




3. При сгорании 1 моль С2Н2 в кислороде
С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(ж)
выделилось 1299,60 кДж теплоты. Рассчитать, пользуясь таблицей термодинамических данных, теплоту образования ацетилена 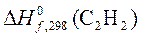 .
.
Решение:
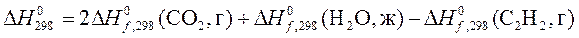


 .
.
4. При стандартных условиях теплота полного сгорания белого фосфора 760,1 кДж/моль, а теплота полного сгорания черного фосфора 722,1 кДж/моль. Найти теплоту превращения черного фосфора в белый.
Решение:
Р(ч) + 5/4О2 = 1/2Р2О5, D Н 1 = –722,1 кДж/моль
Р(б) + 5/4О2 = 1/2Р2О5, D Н 2 = –760,1 кДж/моль
Р(ч) ® Р(б), D Н 3
По закону Гесса:
D Н 3 = D Н 1 – D Н 2 = –722,1 + 760,1 = 38 кДж/моль.
5. Теплоемкости Н2, О2 и Н2О (все вещества – газы) равны 28,8; 29,3; 33,6 Дж/(моль×К) соответственно в диапазоне температур от 25°С до 100°С. При температуре 25°С известно изменение энтальпии в реакции
Н2 + 1/2О2 = Н2О,  .
.
Рассчитать тепловой эффект этой реакции при температуре 100°С.
Решение:
Так как теплоемкости приняты постоянными, то

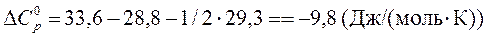

6. Рассчитать, пользуясь таблицей термодинамических данных, тепловой эффект реакции
2N2 + 6H2O = 4NH3 + 3O2
при Т = 400 К (все вещества – газы).
Решение:
Для расчета используем уравнение Кирхгофа (56)
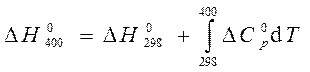
Так как для всех веществ вид уравнения для теплоемкости  в таблице термодинамических величин одинаков, предыдущее уравнение принимает вид
в таблице термодинамических величин одинаков, предыдущее уравнение принимает вид
|
|
|

и после интегрирования


где

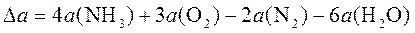
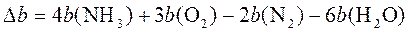


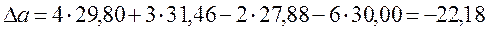
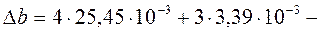



При Т = 400 К тепловой эффект равен



Задачи для самостоятельного решения
1. Найти изменение теплоемкости 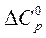 для реакции
для реакции
3С2Н2 ® С6Н6
при 75°С, если средние мольные изобарные теплоемкости ацетилена и бензола при этой температуре соответственно равны 10,43 и 32,0 ккал/(моль×К).
(Ответ: 0,71 ккал/(моль×К))
2. Определить D U реакции СаСО3 = СаО + СО2 при 900°С, если D Н при этой же температуре равно 42,560 ккал/моль.
(Ответ: 168,3 кДж/моль)
3. В стандартных условиях теплота сгорания Н2 в О2 равна 286,2 кДж/моль, а теплота сгорания Н2 в О3 равна 333,9 кДж/моль. Найти теплоту образования озона из кислорода.
(Ответ: 15,9 кДж/моль)
4. Даны уравнения химических реакций:
а) Н2(г) + 1/2О2(г) = Н2О(ж), D Н 1 = – 68,3 ккал;
б) СаО(тв) + Н2О(ж) = Са2+(aq.) + 2ОН–(aq.),D Н 2 = – 19,5 ккал;
в) Са(тв) + 2Н2О(ж) = Са2+(aq.) + 2ОН–(aq.) + Н2(г),
D Н 3 = – 190 ккал.
Рассчитать тепловой эффект реакции
Са(т) + 1/2О2(г) = СаО(т), D Н 4 –?
(Ответ: –238,8 ккал)
5. Рассчитайте, пользуясь справочными данными, сколько энергии надо затратить для разложения 9 г Н2О на простые вещества в стандартных условиях?
(Ответ: 142,9 кДж)
6. Рассчитайте, пользуясь справочными данными, на сколько увеличится энтальпия человека, потребившего продукт, содержащий 80 г углеводов, 25 г белков, 32 г жиров и какое количество теплоты выделится при сжигании таких же количеств указанных питательных веществ в калориметре?
(Ответ: 728,1 ккал; 768,1 ккал)
7. Рассчитайте, пользуясь справочными данными, стандартное значение энтальпии реакции окисления сероводорода в избытке кислорода и в недостатке кислорода при температуре 25°С.
(Ответ: –562,13 кДж/моль; –265,23 кДж/моль)
8. Рассчитать, пользуясь справочными данными, тепловой эффект реакции образования HCl(г)
СН4(г) + 3Cl2(г) = CHCl3(г) + 3HCl(г)
при Т = 600 К.
(Ответ: –298,6 кДж)
9. Для реакции
CH3OH(г) + 3/2O2 = CO2 + 2H2O(г)
зависимость теплового эффекта (Дж) от температуры выражается уравнением
|
|
|
D H = – 684710 + 36,77 T – 38,56×10–3 T 2 + 8,21×10–6 T 3 +
+ 2,88×105 / T
Рассчитать изменение теплоемкости  для этой реакции при 500 К.
для этой реакции при 500 К.
(Ответ: 3,2155 Дж/К)
Второе начало термодинамики. Энтропия
Основные уравнения
Второе начало термодинамики (С.Карно, 1824 г.) устанавливает критерий направленности термодинамических процессов Известно много формулировок второго закона термодинамики, которые эквивалентны друг другу.
Ø Р.Клаузиус (1850 г.): Теплота не может самопроизвольно переходить от более холодного тела к более горячему
или другая формулировка:
Ø В.Оствальд (1888 г.): Осуществление вечного двигателя второго рода невозможно
Аналитическое выражение второго начала термодинамики (неравенство Клаузиуса):
 , ,
| (60) |
где S – энтропия (введена Р.Клаузиусом); знак "=" относится к обратимым процессам, а знак ">" – к необратимым.
Для изолированных систем уравнение второго начала термодинамики упрощается:
 , ,
| (61) |
то есть энтропия изолированной системы в необратимых условиях может только возрастать, а в состоянии термодинамического равновесия она постоянна (достигает максимума).
В расчетах используют стандартную энтропию  . Стандартной называют энтропию при стандартном давлении р 0=1,013×105 Па и температуре Т (К). Для удобства сравнения и табулирования энтропии веществ относят к стандартной температуре 298 К.
. Стандартной называют энтропию при стандартном давлении р 0=1,013×105 Па и температуре Т (К). Для удобства сравнения и табулирования энтропии веществ относят к стандартной температуре 298 К.
Расчет энтропии1 моль вещества при произвольной температуре и постоянном давлении, если в процессе нагревания не происходит изменения агрегатного состояния, производят по уравнению:
 , ,
| (62) |
а изменение энтропии в процессе нагревания 1 моль вещества от температуры T 1 до температуры T 2 без изменения агрегатного состояния при постоянном давлении по уравнению:
 . .
| (63) |
Если теплоемкость не зависит от температуры, то уравнения (62) и (63) упрощаются:
 , ,
| (64) | |
 . .
| (65) | |
Энтропию и изменение энтропии веществ при постоянном объеме рассчитывают по уравнениям, которые аналогичны уравнениям (62) – (65):
 , ,
| (66) |
 , ,
| (67) |
 , ,
| (68) |
 . .
| (69) |
Изменение энтропии при фазовом переходе (плавление, кристаллизация, испарение, конденсация, возгонка) вычисляется по уравнению:
 . .
| (70) |
Изменение энтропии в процессе изменения объемаn моль идеального газа от V 1 до V 2 (Т – const) равно:
|
|
|
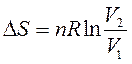
| (71) |
или, учитывая, что  ,
,
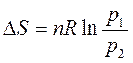 . .
| (72) |
Изменение энтропии в химической реакции рассчитывают по формуле:
 , ,
| (73) |
где  и
и  – суммы стандартных энтропий продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
– суммы стандартных энтропий продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
|
|
|


