 |
Примеры решения типовых задач
|
|
|
|
1. Рассчитать массу 1 м3 азота, если его давление равно 3 атм, а температура 20°С?
Решение:
В этой задаче удобно применить уравнение Менделеева – Клапейрона (22):
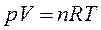 или
или 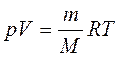
Находя из этого уравнения массу азота m, получим

Переведем давление из атмосфер в кПа (Приложение 1):
p = 3×101,3 = 303,9 (кПа)
Переведем объем из м3 в литры:
V = 1×103 = 103 (л)
Переведем температуру из шкалы Цельсия (t) в шкалу Кельвина (T), округляя 273,15 до 273 (однако при точных расчетах нужно брать 273,15):
Т = t + 273 = 20 + 273 = 293 (К)
Рассчитаем массу азота:
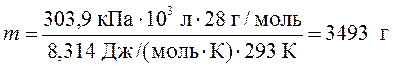
2. В промышленном процессе азот необходимо нагреть до температуры 500 К в реакторе постоянного объема. Какое давление будет иметь азот, если вначале он имеет давление 100 атм при температуре 300 К?
Решение:
Предположим, что азот ведет себя как идеальный газ. Для расчета используем уравнение закона Шарля (25)
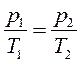
Подставляя в него известные температуры и давление, получим

3. Рассчитать работу, совершаемую при расширении 3 моль кислорода от объема 0,005 м3 до объема 0,01 м3 при постоянном давлении 101,3 кПа.
Решение:
Переводим объемы газов в литры
V 1 = 0,005×103 = 5 (л) V 2 = 0,01×103 = 10 (л)
Используем уравнение (28) для работы при изобарном расширении газа, получим
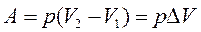
A = 101,3×(10 – 5) = 506,5 (Дж)
4. Азот расширяется от начального давления 1 атм и объема 25 л при постоянной температуре 15°С до объема 100 л. Рассчитать работу, совершаемую азотом, и его конечное давление.
Решение:
Переводим давление в кПа
p = 1×101,3 = 101,3 (кПа)
а температуру в шкалу Кельвина
T = t + 273 = 15 + 273 = 288 (К)
Рассчитываем количество азота

Расчет работы проводим по уравнению (30) для изотермического процесса расширения
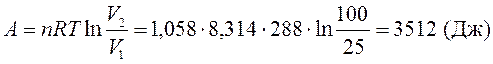
Для расчета конечного давления воспользуемся уравнением Менделеева – Клапейрона (22)
|
|
|
 ,
, 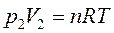
Так как температура и количество азота при расширении остается постоянным, то в соответствии с уравнением закона Бойля – Мариотта (23) получим
 и
и 
5. Рассчитать работу, совершаемую при протекании реакции брожения 1 моль глюкозы при температуре 298 К:
С6Н12О6 ® 2С2Н5ОН + 2СО2
Решение:
Когда в реакцию вступает 1 моль С6Н12О6, выделяется 2 моль СО2. Газ оттесняет окружающую атмосферу и производит работу, которую можно рассчитать по уравнению (31):

Так как в уравнении рассматриваемой реакции среди реагентов газообразных веществ нет, то
D n = 2 – 0 = 2 (моль).
Работа, совершаемая при протекании реакции брожения, равна
A = 2 моль×8,314 Дж/(моль×К)×298 К = 4955 Дж.
6. Когда одному грамму воды сообщается 1 калория теплоты (изобарные условия) при 14,5°С, ее температура повышается до 15,5°С. Найти мольную теплоемкость воды.
Решение:
Для расчета используем уравнение, следующее из (43)

Переведем количество тепла в Дж
Qp = 1×4,184 = 4,184 (Дж)
Рассчитаем количество воды

и среднюю мольную теплоемкость воды в исследованном интервале температур (она с хорошей точностью равна истинной, так как диапазон температур, в котором проводились измерения, невелик)
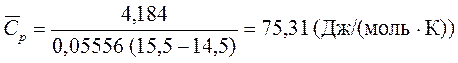
7. Сколько теплоты нужно затратить для нагревания 1 кг воды от температуры 25°С до точки кипения при давлении 101,3 кПа? Теплоемкость жидкой воды принять в качестве первого приближения постоянной и равной 75,48 Дж/(моль×К).
Решение:
Для расчета используем уравнение, которое следует из (43)


8. Рассчитать, пользуясь таблицей термодинамических величин, изменение энтальпии при изобарном нагревании двух моль циклогексана (газообразного) от 298 К до 350 К. Учесть, что теплоемкость циклогексана зависит от температуры.
Решение:
Для расчета используем уравнение, следующее из уравнения (45)

Коэффициенты уравнения зависимости теплоемкости газообразного циклогексана от температуры находим в таблице термодинамических величин (см. приложение 9, с. 5)
|
|
|

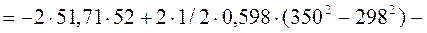

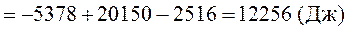
|
|
|


