 |
Задачи для самостоятельного решения.
|
|
|
|
1. Какой объем занимают 16 кг кислорода при н.у.?
(Ответ: 11,2 м3)
2. Образец воздуха занимает объем 1 л при комнатной температуре и давлении 101,3 кПа. Какое давление необходимо, чтобы сжать его до объема 100 см3 при этой же температуре?
(Ответ: 1013 кПа)
3. До какой температуры надо охладить 1 л идеального газа, который вначале имеет температуру 20°С, чтобы его объем уменьшился до 80 мл?
(Ответ: 23,44 К)
4. Какое давление будет иметь ксенон массой 131 г при температуре 25°С в сосуде объемом 1 л, если считать, что он ведет себя как идеальный газ?
(Ответ: 24,4 атм)
5. В сосуде объемом 0,04 м3 находится 77 г диоксида углерода при давлении 106,6 кПа. Рассчитать температуру газа.
(Ответ: 293 К)
6. Какой объем занимают при н.у.: а) 5 г О2; б) 0,3 моль SO2; в) смесь 0,3 моль N2 и 11 г СО2?
(Ответ: 3,5 л; 6,72 л; 12,3 л)
7. Рассчитать работу, совершаемую при растворении 50 г железа в хлороводородной кислоте при 25°С в: а) открытом стакане; б) запаянном сосуде.
(Ответ: 2212 Дж; 0 Дж)
8. В сосуде сечением 100 см2 с незакрепленной перегородкой проводится химическая реакция. В течение всего опыта внешнее (атмосферное) давление равно 1 атм. Во время реакции объем реакционной смеси увеличивается и перегородка перемещается на 10 см. Какую работу совершает химическая реакция над окружающей средой?
(Ответ: 101,3 Дж)
9. Теплоемкость гелия при постоянном давлении равна 20,8 Дж/(К×моль). Сколько теплоты необходимо затратить для повышения температуры 1 моль гелия на 10 К, когда он находится: а) в сосуде при постоянном объеме и начальном давлении 10 атм; б) в сосуде с поршнем при постоянном внешнем давлении 10 атм?
(Ответ: 124,9 Дж; 208 Дж)
10. Чайник, содержащий 1 кг кипящей воды (температура равна 100°С, давление – 1 атм), нагревают до полного испарения. Рассчитать: а) работу; б) теплоту; в) изменение внутренней энергии; г) изменение энтальпии в процессе испарения (необходимые справочные данные взять в приложении 6).
|
|
|
(Ответ: 172,3 кДж; 2259 кДж; 2086 кДж; 2259 кДж)
11. Как изменяется наша внутренняя энергия, когда мы съедаем 100 г белого хлеба (50 г углеводов, 8 г белков, 2 г жиров, 40 г воды)? Необходимые для расчета справочные данные взять в приложении 10.
(Ответ: 255,45 ккал)
Термохимия
Основные уравнения
В основе термохимических расчетовлежит закон Гесса.
Ø Тепловой эффект зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, то есть от числа и характера промежуточных стадий
Проводить термодинамические расчеты удобно, используя следствия из закона Гесса.
Ø Следствие 1. Стандартная энтальпия (тепловой эффект) химической реакции равна разности суммы стандартных энтальпий образования продуктов реакции и стандартных энтальпий образования исходных веществ. Суммирование проводят с учетом числа молей веществ, участвующих в реакции, то есть стехиометрических коэффициентов.
Под тепловым эффектом химической реакции понимают значение D Hr или D H (которое называют просто "энтальпией реакции") или D Ur или D U.
Для того, чтобы сократить объем справочных таблиц и облегчить сравнение энтальпий различных реакций используют понятие "стандартное состояние".
Ø Стандартное состояние – это состояние чистого вещества при давлении 1 атм и заданной температуре.
Для реакции вида
а А + b B = c C + d D
стандартное изменение энтальпии рассчитывают по известным табличным значениям стандартных энтальпий образования продуктов и реагентов:
 , ,
| (50) |
где f означает formation – образование.
Стандартная энтальпия (теплота) образования вещества, например, Na2CO3 это тепловой эффект реакции образования 1 моля Na2CO3 из металлического натрия, углерода (графита) и кислорода, находящихся в наиболее устойчивых стандартных состояниях
|
|
|
2Na(тв) + С(тв) + 3/2О2(г) = Na2CO3(тв),
 . .
| (51) |
Энтальпия образования наиболее устойчивой модификации любого простого вещества в стандартном состоянии принята равной 0 при любой температуре. В справочниках (см., например, приложение 9) приводятся стандартные энтальпии образования простых веществ при температуре 298,15 К, которую для упрощения записывают как 298 К.
Понятие "энтальпия образования" используют не только для обычных веществ, но и для ионов в растворе. При этом за точку отсчета принят ион Н+, для которого стандартная энтальпия образования в водном растворе принята равной нулю
В термохимических уравнениях указывают не только формулы веществ, но и их агрегатные состояния или кристаллические модификации.
Ø Следствие 2. Стандартная энтальпия (тепловой эффект) химической реакции равна разности суммы стандартных энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов)
 , ,
| (52) |
где с означает combustion – сгорание.
Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчетов тепловых эффектов органических реакций.
Ø Следствие 3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связи А–В называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние.
АВ(г) ® А (г) + В(г)
Энергия связи всегда положительна.
Уравнение, связывающее между собой тепловой эффект (энтальпию) химической реакции D Hr и изменение теплоемкости в процессе протекания химической реакции для изобарного  D Ср и изохорного D СV процессов в дифференциальной форме:
D Ср и изохорного D СV процессов в дифференциальной форме:
 , ,
| (53) |
 , ,
| (54) |
и в интегральной форме:

| (55) |
или
 . .
| (56) |
называют уравнением Кирхгофа.
Изменение теплоемкости в процессе протекания химической реакции связано с теплоемкостями продуктов и исходных веществ:

| (57) |
или для реакции вида а А + b B = c C + d D
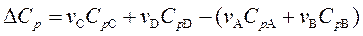 . .
| (58) |
Уравнение Кирхгофа позволяет рассчитать изменение теплоемкости при протекании химической реакции, если известна зависимость теплового эффекта химической реакции от температуры (для этого используется дифференциальная форма уравнения) или рассчитать тепловой эффект реакции при любой температуре T 2, если он известен при другой температуре T 1 (для этого используется интегральная форма уравнения).
|
|
|
Если в интервале температур от Т 1 до Т 2 можно пренебречь зависимостью  D Ср от Т, то уравнение (56) принимает более простой вид:
D Ср от Т, то уравнение (56) принимает более простой вид:
 . .
| (59) |
|
|
|


