 |
Иммунологические проблемы при раке 5 Глава
|
|
|
|
Этого не происходит на уровне интерстициальных образований, то есть на тканевом уровне, на котором отсутствует указанный механизм защиты. Опасность хирургического лечения заключается не столько в диссеминации раковых клеток в крови, которая может с этим явлением бороться, а распространении их на тканевом уровне, уже лишенном механизма защиты. На указанном уровне раковая клетка имеет все шансы не только задержаться, но и дать начало росту.
Независимость защитного механизма на разных уровнях также должна приниматься во внимание при объяснении различий в событиях, следующих вслед за появлением спонтанной опухоли и тех, которые возникают после пересадки опухолей в эксперименте.
ЭКСПЕРИМЕНТАЛЬНЫЙ КАНЦЕРОГЕНЕЗ
Проблема канцерогенеза представляется в новом свете при учете представленной выше концепции. Классической экспериментальная индукция признается лишь тогда, когда в результате образуется инвазивная форма опухоли, то есть, когда наблюдается инвазия измененными клетками окружающих тканей. Считается, что указанное явление происходит вследствие фундаментального специфического изменения, трансформирующего нормальные клетки в раковые. Собственно указанная болезнь происходит из связи этих измененных клеток с организмом. (290, 291, 303) К указанным выше простым постулатам ракового превращения мы предлагаем еще один.
По нашему мнению, рак представляет собой иерархически организованное состояние. Его инвазивная форма представляет собой лишь одну из фаз в длинном ряду изменений, которые преобразуют иерархические объекты в раковые. Таким образом, канцерогенез представляет собой не просто изменение нормальной клетки в раковую, но также постепенное иерархическое развитие. Клетку признают раковой, если она обладает раковым ядром. Последнее может считаться раковым, если, соответственно, оно сформировано из раковых хромосом. Последние, в свою очередь, признаются раковыми, если их образуют раковые гены. Следуя этой логике, можно дойти до нуклеопротеинов, даже до гистонов и щелочных аминокислот, чтобы обнаружить первые, специфичные для рака, изменения на указанных низших ступенях организации биологического царства. Другими словами, клетка становится раковой только тогда, когда, составляющие ее объекты низких уровней, претерпевают специфические изменения. Таким образом, случай успешной индукции экспериментального рака в инвазивной фазе означает также универсальное поражение всего ряда иерархически низших объектов, включая клетки, что и придает опухоли инывазивный характер. Канцерогенез, рассматриваемый в данном аспекте, не должен восприниматься в качестве простого процесса, затрагивающего клетки, а как завершение организованных процессов.
|
|
|
Это становится еще более интересным, если учесть, что изменения в составляющих наиболее низких уровней организации может происходить на статистической основе, то есть независимо от непосредственного вмешательства агентов извне. Поскольку указанные изменения должны разрабатываться для многих последовательных иерархических объектов, требуется определенное время для их реализации. Это объясняет, почему большинство раковых опухолей возникает после определенного возраста. Клетки, имеющие ядра с раковыми изменениями, т. е., находящиеся в прединвазивной фазе, часто встречаются у пожилых людей во многих органах, не вызывая клинических проявлений. С концептуальной точки зрения, веществу, чтобы считаться действенным канцерогеном, должно быть свойственно действие на указанные неинвазивные объекты в такой мере, чтобы быть способным изменить их на инвазивные. Таким образом, оно должно быть способным воздействовать на объекты, которые уже самостоятельно продвинулись в иерархическом развитии ракового процесса достаточно далеко, достигнув неинвазивной фазы, в отсутствие ее проявлений. Тот факт, что, даже для самых активных агентов, требуется много времени для индукции инвазивного рака, свидетельствует в пользу того, что процесс перехода от уже существующего неинвазивного рака в инвазивный не столь прост. Индукция должна касаться нескольких, или всех, субклеточных уровней и изменения в них должны быть множественными.
|
|
|
Мы склонны следовать последней из упомянутых гипотез, обязывающей нас считать, что канцероген вызывает изменения на разных уровнях организации. Это положение подтверждается рядом фактов. Кроме способности вызывать образование инвазивных опухолей, канцерогены также индуцируют предопухолевые состояния, соответствующие раковым объектам неинвазивной фазы. При индуцированным канцерогенезе с большим постоянством выявляются измененные ядра, или только измененные хромосомы. Даже агенты, которые способны в большом проценте случаев индуцировать инвазивные формы рака, также вызывают раковые изменения на более низких уровнях. Для канцерогенов, вызывающих развитие инвазивного рака в малом проценте случаев, свойственна приостановка раковых процессов на более низких уровнях организации. Подобная активность на субъядерных уровнях организации проявляется в их способности вызывать мутации и уродства.
В концепции иерархической организации, считается, что мутации являются результатом изменений на генном уровне, притом, что на более низких уровнях изменений не бывает. Уродства проистекают из изменений на хромосомном уровне. Сравнение канцерогенеза с мутациями и уродствами позволило нам предположить, что раковые изменения, в виде мутаций и уродств, начинаются на уровнях нуклеопротеинов, или даже еще более низком. Сложное раковое состояние, к которому относится и инвазивная форма, может рассматриваться в виде результата ряда нарушений, произошедших в ряду разных субтканевых уровней. Канцерогенез на инвазивной стадии обусловлен существованием изменений на всех нижележащих организационных уровнях. Поскольку они могут возникать в процессе организационного развития, указанные изменения могут ускоряться, или даже индуцироваться, канцерогенами.
|
|
|
Концепция, признающая множественные изменения при канцерогенезе, побудила нас к поиску множества факторов, заключенных в самих канцерогенах. Возможность того, что подобные факторы могут быть обнаружены, следует из существования так называемых коканцерогенных агентов. Это вещества, не имеющие собственной канцерогенной активности, однако способные проявить таковую в случаях, когда назначают некоторые канцерогены в столь малых дозах, которые сами по себе не могут индуцировать инвазивный рак. Подобная природа действия коканцерогенов объясняется множественностью факторов канцерогенеза.
Можно предположить, что факторы, имеющиеся в канцерогене, обладают неравной активностью. Эта разница становится очевидной при назначении канцерогена в очень малом количестве. В то время, как некоторые факторы сохраняют достаточную силу в указанных малых количествах для реализации своего участия в сложном процессе канцерогенеза, другие оказываются количественно недостаточными для провокации изменений. В итоге получается неполный набор изменений. В этих условиях дополнительное включение канцерогена может заместить действие количественно дефицитных факторов и обеспечить полное множественное действие, необходимое для возникновения инвазивного рака. Поскольку один какой-либо коканцероген способен заместить только определенные факторы, активность коканцерогена характеризуется определенной специфичностью.
Следуя гипотезе множественности действий одного и того же канцерогена, следующим шагом должна стать попытка их распознавания. Исследование, идентифицирующее разные активные энергетические центры в структуре канцерогенов, помогает обосновать указанную гипотезу.
Мы попытались, в качестве первого шага, систематизировать анализ подобных энергетических центров в канцерогенах. Здесь мы представляем краткое резюме этого исследования.
|
|
|
Энергетические факторы
Хорошо известная и общепринятая концепция стремится увязать канцерогенную активность с присутствием одного энергетического фактора, обозначаемого как "конденсация электронов" в определенных областях молекулы и обнаруживаемого благодаря физико-математическому подходу, предложенному Pulman и Dawdel.
Изучение роли распределения электронов при канцерогенезе были начаты Otto Schmidt (43), который показал, что требуется электронная плотность, превышающая 044e/a2 в мезообласти молекулы, необходимая для реализации канцерогенных свойств. Указанная концепция была частично изменена Pulman, Dawdel и соавторами (44), показавшими, с применением квантового анализа разных канцерогенов, что плотность электронов возрастает в некоторых избранных областях молекул, К-регионах. Они продемонстрировали, что при превышении в указанных регионах электронной плотности 1.292e, вещество обладает канцерогенными свойствами. Рисунок 95 демонстрирует такой К регион.

9:10 Диметил 1:2:7:8 дибензантрацен Рис. 95. Регионы К в канцерогенных молекулах.
С нашей точки зрения, крайне интересный аспект подобной конденсации электронов заключается в двух фактах: наличии в некоторых молекулах канцерогена более чем одного такого К-региона и наличии разных значений указанных К-регионов в разных молекулах. Именно наличие нескольких К-регионов в одной молекуле обусловливает их участие в более чем одном процессе, обеспечивая множественную активность.
Дальнейший анализ, тем не менее, позволил установить, что уплотнение электронов в К-регионе будет представлять лишь один из факторов, индуцирующих активность указанных агентов. Мы установили иной энергетический фактор, заключавшийся в присутствии двух атомов, имеющих одинаковый электрический заряд, и связанных друг с другом в молекуле.
Близнецовые образования
Мы рассматривали существование и значение указанных "близнецовыеобразований" в качестве указателя энергетической активности в процессе исследования организации молекулярных электронов. В молекуле чередование простых и кратных связей обусловлено, частично, такой же полярности указанных атомов в молекуле и, частично, противоположными свойствами двух атомам углерода, образующих уксусную кислоту, важную предшественницу в процессе биологического синтеза. Эффект индукции энергетического центра в молекуле проводит себя по цепи благодаря противоположной полярности. Присутствие любого энергетического центра в молекуле, представленного полярными группами или, например, латеральной цепью, приведет к увеличению указанной альтернативной полярности. Когда один, или больше, подобных индуктивных эффектов продвигаются по цепи, два соседних атома нуждаться в одинаковом электрическом знаке для своего заряда или ионном свойстве. Полученное, таким образом, близнецовое образование представляет центр увеличенной молекулярной реактивности. Последняя может быть столь интенсивной, что может привести к разрыву молекулы, что часто происходит в неорганических веществах. Это дало основание Pauling считать, что это состояние, называемое "правило соседнего заряда", не может существовать.
|
|
|
"Pauling указывал, что взаимная потенциальная энергия двух электрических зарядов одного знака столь высока, что традиционная структура, содержащая сетевые остаточные заряды того же знака на любом из соседних атомов, будет иметь слишком высокий уровень энергии, чтобы оказать благоприятное влияние на действительную структуру молекулы". Это отмечает William A. Waters в "Физических аспектах органической химии". (45)
Форма, предложенная для перекиси азота (N2О4), (Рис.96) окажется невозможной из-за высокой энергии, развившейся в двух положительно заряженных атомах азота.

Перекись азота
Рис. 96. Существование молекулы перекиси азота предотвращается высокой энергией, образовавшейся на двух соседних положительно заряженных атомах азота.
Тем не менее, силы, существующие в большинстве органических молекул много слабее. Поэтому, образующиеся «близнецовые образования», хотя и являются энергетически мощными, недостаточно сильны для индуцирования разрыва молекулы. Тем не менее, они будут существовать, и представлять важные энергетические центры.
Мы изучили ряд канцерогенов в поиске тех, которые образуют близнецовые формирования. Анализ ионного характера атомов углерода в молекуле метилхолантрена выявляет присутствие близнецовых образований, которые могут располагаться в разных точках молекулы. Рисунок 97 демонстрирует энергетический аспект метилхолантрена и ионную характеристику его атомов углерода. Индукция одинакового знака на двух соседних атомах углерода определяется наличием в молекуле циклопентановой группы. А присутствие метиловой группы определяет электрические свойства С20 и, также, приобретение противоположных знаков. С другой стороны, двойные связи будут определять возможную локализацию указанных близнецовых образований в молекуле в самом образовании К, находящемся у C5 и C6.

20-Метилхолантрен
Рис. 97. Энергетическая часть метилхолантрена с близнецовыми образованиями.
Близнецовые образования находят во многих канцерогенах. Неодинаковые энергетические величины легко определяются у разных близнецовых образований, и помогают объяснить их различную активность. Этот факт обусловлен, возможно, множеством свойств этой группы качественно одинаковых энергетических образований.
Другой аспект связи между указанными образованиями и канцерогенезом оказывается еще более интересным. Хотя в некоторых агентах близнецовых образований не выявлено, они присутствуют в веществах, получаемых в организме в результате метаболизма указанных агентов. Связь близнецового образования с канцерогенной активностью может быть заподозрена в случае одновременного возникновения этих изменений с канцерогенностью.
Например, в 2 нафтиламине, прямая канцерогенность которого под вопросом, близнецовые образования не возникают, (Рис.98). Однако, они образуются в гетероциклическом 3:4:5:6 дибензкарбазоле, одном из его промежуточных веществ (46), известном своими канцерогенными свойствами. (Рис.98 бис) Это также наблюдается у аминофлюорена, который также связан с 2 нафтиламином. (Рис.99)

Рис.98. 2-нафтиламин без близнецовых образований.
Наличие близнецовых положительных углеродных групп, или близнецовых отрицательных, в этой же молекуле, может служить еще одним подтверждением разнородности опухолей, производных от указанного канцерогена и его ацетилового производного, имеющего такую же энергетическую картину. (47, 48, 49, 50, 51, 52) Более того, именно связь близнецового образования с канцерогенностью указывает на необходимость учета метаболизма разных канцерогенов в организме.
Диметиламиноазобензин, масляно желтый, обладающий близнецовым образованием и являющийся активным канцерогеном, может становиться еще более активным вследствие метаболических изменений, происходящих в организме, приводящих к появлению продуктов с близнецовыми атомами углерода. Тот же 2:2/-азонафталин, обладающий близнецовым образованием, становится активнее в результате своей трансформации в амины, проходящей через гидразные соединения. 2:2'-диамино-l:l'-динафтил, с близнецовым атомоуглеродным образованием,

Рис.98 бис. Близнецовое образование появляется в промежуточном 3:4:5:6 дибензкарбазоле.
Углеродных близнецов можно связать со степенью канцерогенности серных изомеров sulfur isosters (53), в каждом из которых тиофеновое ядро замещает бензиновое кольцо 9:10 диметил 1:2 бензантрацена. Это также касается азо соединений с близнецовыми образованиями на уровне азо связи. Рисунок 100 демонстрирует наличие близнецового азота на уровне азо связи вследствие влияния, оказываемого симметричными кольцами.

Рис.99. Близнецовая углеродная группа, присутствующая в аминофлюорене.

Рис. 100. Близнецовое образование присутствует в 4-диметиламиноазобензине на уровне азо связи.
более активен, чем предшественник, 2:2 азонафталин. (54), (Рисунки. 101 и 102)
Возможно, что именно бензидиновые преобразования гидразного производного определяет близнецовое образование, а посему, и объясняет его канцерогенность.
Одинаковость видов опухолей, вызванных производными 4 аминостильбина (Рис.103), и производными аминофлюорина (55), заставило нас думать, что близнецовые образования могут в этом случае появляться путем изменений, происходящих в организме.
Некоторые высоко активные искусственные эстрогены, (56) диэтилстильбэстрол и трифенилэтиленовая кислота, (57), (Рис. 104 и 105) известны своей канцерогенностью. Поскольку близнецовый углерод присутствует в обоих веществах, подобное образование может обладать повышенной активностью в результате метаболических изменений в организме. Интересный аспект возникает у уретана и других эфиров карбамовой кислоты. Рис. 106 показывает, что нет непосредственных, или производных, изменений в молекуле, а также свидетельств наличия близнецовых образований. Это согласуется с недостатком способности указанных веществ, отмечаемой многими авторами, вызывать раковые изменения или даже опухоли. (58, 59, 60) Orr (61) указывает на связь, существующую между поражениями, вызванными эфирами карбамовой кислоты с хроническим воспалением, а также отмечает их регресс при прерывании лечения. (Заметка 1)

Рис.101. 2:2'азонафталин обладает лишь слабой активностью.
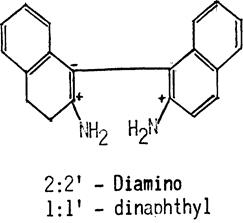
Рис.102. Переход 2:2' азонафталина в активный 2:2'-диамино 1:l'-динафтил приводит к появлению активного близнецового углеродного образования вследствие влияния, оказываемого аминогруппой.
Исходя из проведенного анализа веществ, способных вызывать инвазивные формы рака, можно заключить, что многие из них содержат близнецовые углеродные, или азотные, образования, которые обычно активируются путем индукции. Последняя обусловлена воздействием полярной группы или двойных связей. Некоторые из указанных веществ, изначально не имеющие близнецовых образований, становятся канцерогенами только тогда, когда в организме происходят изменения, ведущие к появлению близнецового образования.

Рис.103. Производное 4-аминостилбина.
Следует, однако, учитывать, что в соответствии с концепцией множественности факторов канцерогенеза, близнецовые образования не являются обязательным атрибутом канцерогенности, подобный эффект возможен при воздействии и иных факторов.
Интересно отметить, что во многих канцерогенах, особенно в углеводородах, близнецовые образования являются гидрофобными благодаря обогащенности электронами. Сейчас мы лишь хотим подчеркнуть, что в веществе, которое считают канцерогенным, то есть способным индуцировать инвазивный рак, близнецовое образования являются дополнительным фактором, обеспечивающим сложную активность. Участие групп двух энергетических центров одинакового характера, в канцерогенах, с новой стороны освещает группу агентов, которые, при определенных обстоятельствах, индуцируют опухоли. Oдна группа с алкилирующей активностью сформирована из nitrogen mustards, diepoxides, полиэтиленовых аминов и диметансульфоноксиалканов. Одной из физико-химических характеристик этой групп является присутствие двух электрофильных центров, расположенных столь близко друг к другу, что делает возможным их совместное действие.

Рис.104. Близнецовое образование существует в диэтилстильбэстроле.

Рис.105. Положение близнецового образования в трифенилэтилене.
Еще более важным нам кажется факт, согласно которому, благодаря изменениям во всех указанных веществах, могут появиться новые образования, которые энергетически могут быть признаны в высшей степени похожими на близнецовые образования. Учитывая указанную характеристику, возможна их активность, сходная с той, которая свойственна рассмотренным выше канцерогенам.
NH2-CO-OC2H5 Уретан
Рис.106. Уретан не обладает близнецовым образованием и очевидно—по данным многих авторов —не обладает непосредственной канцерогенной активностью.
Производные Nitrogen Mustard
Наиболее представительными и изученными веществами этой группы являются производные nitrogen mustard, характеризующиеся наличием 2-галоэтиламиновой группы (Рис.107), сцепленной с радикалом, который может быть алифатическим или ароматическим. Вероятно, что это соединение становится биологически активным в результате процесса гидролиза, а Haddow показал, что активность присутствует только в случаях, когда содержание гидрола является достаточно высоким. (62) Неравенство гидролиза у разных членов может быть связано с влиянием, оказываемым радикалом, связанным с азотом. Кажется вероятным, что присутствие более сильного энергетического центра, как это происходит в положительно или отрицательно заряженных атомах, связанных с циклическим радикалом, уменьшает диссоциацию хлорэтиловой группы. Обычно, нуклеофильные группы задерживают диссоциацию. Существует немало доказательств того, что вслед за элиминацией иона хлора и появлением иона, в качестве реактивированного промежуточного продукта, наблюдается биологическая активность. Дальнейший переход к иону этиленимониума, считающемуся более стабильным и, поэтому, менее реактогенным, вероятно, завершает трансформацию. Рисунок 107 демонстрирует указанные изменения

Рис.107. Производные nitrogen mustard.
Галоалькильные боковые цепи этой молекулы незаменимы для ее биологической активности. (63, 64, 65, 66) Они приводят к промежуточному появлению двух положительных электростатических энергетических центров. Согласно Landing и соавторам, это не является минимальным состоянием. (67, 68) Эти исследователи показали, что в nitrogen mustards цитотоксичность увеличивается с числом галоалкильных боковых цепей. Следует отметить, что двойной электрофильный центр обнаруживается не только в двух оригинальных галоалкильных боковых цепях, но также и в более позднем продукте - ионе ethyleneimonium ion. Учитывая довольно частое появление указанного иона в других агентах, представляет интерес анализ связи этой группы с близнецовым образованием.
В группе ethyleneimonium, в то время как отрицательный заряд наблюдается у азота, положительный заряд присутствует между двумя CH3, обеспечивая определенную полярность. Имея два положительно заряженных атома углерода в сравнительно фиксированном положении, указанная группа оказывается энергетически идентичной положительной близнецовой углеродной группе. Двухступенчатое изменение, первой - imonium группы и второй – углеродной, может объяснить, как мы увидим в дальнейшем, странную биологическую активность nitrogen mustards, обладающих канцерогенной активностью только в результате изменений, происходящих в организме

Рис.108. Изменения, происходящие в nitrogen mustard, приводят к образованию ethyleneimmonium, энергетический аспект которого идентичен таковому присутствующего близнецового образования.
Это очень согласуется с сущностью более недавно изученных активных канцерогенов, этилениминов, у которых обнаружены идентичные центры. (Рис.109). Биологическое действие этилениминовой группы считается связанным с реактогенным промежуточным продуктом.
В общем, если достаточное влияние оказывает другой центр в молекуле, иминовая группа становится активной. Указанный центр может быть нитро группой, как у 2:4 динитрофенилэтиленимина, или другими этилениминовыми группами, как у метиленимина 1:3:5 триазина. (Рис.110) Благодаря влиянию, оказываемому указанными центрами, этилениминовая группа может иметь достаточно заряженные атомы углерода, чтобы стать диэлектрофильным образованием. Вероятность образования реактогенного промежуточного продукта и более стабильной электрофильной формы, таким образом, оказывается одинаковой для этих двух групп, mustards и этилениминов.

Рис.109. Этиленимины являются активными канцерогенами, возможно, в связи с их энергетической частью и наличием формирования, идентичного близнецовому образованию.
Эпоксидные канцерогены
Подобная описанной выше ситуация также обнаружена и в случае э поксидных канцерогенов. Канцерогенная активность установлена для веществ, имеющих два эпоксидных центра, расположенных в молекуле в тесной близости. Сам по себе эпоксидный центр может привести к появлению такого же, свойственного иону углерода, как это показано на рисунке 108 и, таким образом, и того же образования, обнаруженного в горечах и этилениминах. Аналогия касается не только этого. Энергетический центр оказывается недостаточным для индукции биологических изменений без участия индуктивной активации. В случае эпоксидов, это обычно вызывается другой подобной эпоксидной группой в этой же молекуле.
Поскольку канцерогенной активности не выявлено в веществах, имеющих одну эпоксидную группу, или две, но расположенные далеко друг от друга, первостепенную важность приобретают индукционные центры. Два энергетических центра, образующие эпоксидную группу, подобную таковым этилениминов, оказываются недостаточно реактогенными, чтобы вызывать значительные изменения. Только усилившись, благодаря взаимной индукции, их реактогенность возрастает достаточно, что бы вызвать появление промежуточного продукта, либо достаточный заряд в этиленовых атомах углерода, для обеспечения биологической активности. Указанные изменения могут быть измерены реакцией с ионом тиосульфата и могут быть связаны с взаимным расположением двух эпоксидных центров.
Биологическая активность диметансульфонооксиалканов может также быть связана с таким же энергетическим образованием. Оно появляется тогда, когда молекула метаболизируется, с тем отличием, что эти два CH2 в этом случае, вероятно, происходят из других цепей. (Рис.110)

Рис.110. Благодаря влиянию, оказываемому нитрогруппой на этиленимин, иминовая группа 2:4 динитрофенилэтиленимина становится диэлектрофильной.
Для метилоламидов вероятна возможность того, что подобный процесс происходит во время изменений, происходящих в организме.
В том, что указанные две формы могут наблюдаться в этих последних группах канцерогенов, можно увидеть некое подтверждение. Одна является электростатически активной; ей свойственен определенный ионный характер. Вторая обладает двойственной электрофильной активностью, которая может быть отнесена на счет близнецового образования с молекулярной реактивностью.
Таким образом, близнецовое образование, со свойственной ему особой реактивностью, оказывается присущей многим канцерогенным агентам. Чтобы быть биологически активным, близнецовое образование должно быть достаточно сильным, что обеспечивается индукционным эффектом, оказываемым другими образованиями в молекуле, такими как двойные связи в параллельных позициях или полярные группы. Близнецовое образование в качестве энергетического центра в молекуле будет оказывать эффект молекулярного поля. Он, таким образом, будет представлять центр молекулярной реактивности, который следует рассматривать таковым при проведении анализа множественной активности.

Рис.111. Изменения, случающиеся в сульфоноксиалканах, приводящие к появлению двух активных центров CH.
Синъюгированные образования
Изучение разных канцерогенов позволило нам распознать и связать с комплексной канцерогенной активностью другого энергетического влияния, оказываемого двумя, или большим числом, двойных связей при их наличии в параллельных взаимных позициях в циклических молекулах. Это привело нас к концепции "синъюгированного образования" с 2, 3, 4, или большим числом, параллельных двойных связей.
При изучении метилхолантрена, одного из наиболее мощных коканцерогенных агентов, учитывается кривая его поглощения в ультрафиолетовом свете. Указанная кривая демонстрируется на Рисунке 112. При рассмотрении конъюгированных образований с двойной связью особым образом может интерпретироваться место и форма пиков. На кривой метилхолантрена можно распознать части, соответствующие обратным кривым, полученным в случаях разных конъюгированных полиенов. Более того, кривая, полученная при проведении спектрального анализа метилхолантрена, может считаться во многом идентичной обращенной кривой смеси конъюгированных полиенов. Рисунок 113 демонстрирует спектральный анализ конъюгированных жирных кислот печени трески, а Рисунок 114 – обращенную кривую смеси конъюгированных жирных кислот жира печени трески, в которых идентифицированы конъюгированные ди-, три-, тетра -, пента- и гексаены. Рисунок 115 демонстрирует сравнение между кривой метилхолантрена и обращенными пиками смеси жирных кислот.
|
|
|


