 |
Типы химической связи в кристаллах
|
|
|
|
Деление химической связи на виды носит условный характер.
Для металлической связи, обусловленной притяжением электронов и ионов металлов, характерны некоторые признаки ковалентной, если принять во внимание перекрывание атомных орбиталей атомов. В образовании водородной связи, помимо электростатического взаимодействия, не последнюю роль играет донорно-акцепторный характер взаимодействия.
Резкую границу между ионной и ковалентной полярной связью также провести невозможно. Отнести любую связь металл-неметалл к ионному типу нельзя. Принято считать ионной связь между атомами, разность электроотрицательности которых больше или равна 2 (по шкале Полинга). Например, в оксиде натрия связь Na2O (3,44 – 0,93 = 2,51) связь ионная, а в бромиде магния MgBr ковалентная полярная связь (2,96 – 1,31 = 1,65).
В реальных веществах все типы химической связи в чистом виде не встречаются. У большинства соединений тип связи носит промежуточный характер. Это возможно, так как природа химической связи едина – это электростатическое взаимодействие электронов и ядер внутри и между атомами, сближенными на расстояние, когда возникает эффективное перекрывание электронных оболочек.
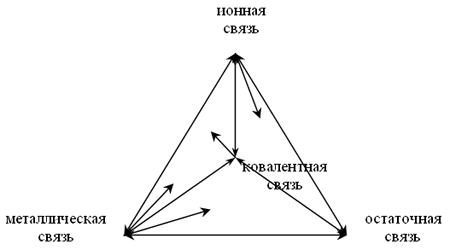
Поэтому возможен непрерывный переход между всеми предельными случаями: ионной, ковалентной, металлической и остаточной связью. Наглядно переход может быть представлен в виде тетраэдра, в вершинах которого помещены крайние представители, по ребрам переходы между двумя типами, а на гранях и внутри объема тетраэдра – сложные смешанные типы связи.
Эффективные радиусы атомов и ионов
Под эффективными радиусами атомов и ионов понимают радиусы действия сфер атомов или ионов, то есть минимальные расстояния, на которых центры сфер атомов или ионов могут приблизиться к поверхности соседних атомов.
|
|
|
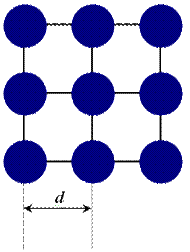
Для определения эффективного радиуса атома или иона структуру кристалла представляют в виде соприкасающихся шаров, расстояние между которыми равно сумме их радиусов. В зависимости от типа химической связи между структурными единицами кристалла различают: металлические радиусы, ионные радиусы, ковалентные радиусы и Ван-дер-ваальсовы радиусы.
Металлические радиусы
Определяется как половина расстояния между соседними атомами, полученного в результате рентгеноструктурного анализа: 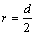
Ионные радиусы
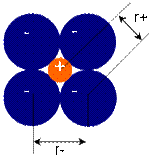
Для вычисления радиусов ионов исходят из предположения, что при достаточно большой разнице в размерах катионов и анионов большие по размеру анионы будут соприкасаться, а меньшие по размеру катионы будут располагаться в пустотах между анионами, тогда радиус аниона будет равен: 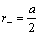 ,
,
радиус катиона равен: 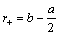 .
.
Ковалентные радиусы
Ковалентные радиусы определяются как половина межатомного расстояния (длины связи): 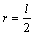 .
.
Кроме того, при расчете ковалентного радиуса учитывается способность некоторых элементов образовывать кратные связи, уменьшающие расстояния между атомами и тип гибридизации центрального атома.
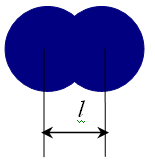
Ван-дер-ваальсовы радиусы рассчитываются для атомов, которые связаны друг с другом только силами межмолекулярного взаимодействия. Рассчитываются как половина расстояния между центрами атомов: 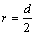 .
.
Поскольку методики расчета атомных и ионных радиусов различны, существует большое число таблиц радиусов.
Ионные кристаллы
Объединение катионов и анионов в кристалл осуществляется благодаря кулоновскому притяжению электрических зарядов. В молекуле 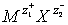 заряды взаимодействуют с силой
заряды взаимодействуют с силой 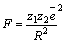 . Величина R – расстояние между двумя ионами. Если это расстояние будет бесконечно далеко, то сила равна нулю. На конечном расстоянии сила взаимодействия двух противоположно заряженных ионов отрицательна, что соответствует притяжению, ионы стремятся сблизиться на минимально допустимое расстояние, которое соответствует устойчивому связанному состоянию. Сила взаимодействия двух одинаково заряженных ионов положительна, что соответствует отталкиванию. Ионы стремятся разлететься и на любом расстоянии не образуют устойчивого соединения. Таким образом, энергия образования кристалла должна быть отрицательной. Такое условие реализуется при образовании ионного кристалла.
. Величина R – расстояние между двумя ионами. Если это расстояние будет бесконечно далеко, то сила равна нулю. На конечном расстоянии сила взаимодействия двух противоположно заряженных ионов отрицательна, что соответствует притяжению, ионы стремятся сблизиться на минимально допустимое расстояние, которое соответствует устойчивому связанному состоянию. Сила взаимодействия двух одинаково заряженных ионов положительна, что соответствует отталкиванию. Ионы стремятся разлететься и на любом расстоянии не образуют устойчивого соединения. Таким образом, энергия образования кристалла должна быть отрицательной. Такое условие реализуется при образовании ионного кристалла.
|
|
|
В ионных кристаллах нет молекул, поэтому не существует границ между структурными единицами. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, поэтому ионная связь не обладает направленностью.
Взаимодействие двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, ионная связь не является насыщенной.
Катионы стремятся себя окружить как можно большим числом анионов так, что кулоновское отталкивание ионов одного знака друг от друга компенсируется взаимным кулоновским притяжением катионов и анионов. Поэтому для структур с ионным типом химической связи характерны высокие координационные числа и плотнейшие шаровые упаковки. Симметрия ионных кристаллов обычно высокая.
Кристаллические вещества с ионным типом химической связи характеризуют диэлектрические свойства, хрупкость, средние значения твердости и плотности, низкая тепло- и электропроводность.
Энергия кристаллической решетки ионного кристалла – это энергия взаимодействия между всеми её ионами, она равна по величине и обратна по знаку энергии, которую необходимо затратить, чтобы разрушить кристаллическую структуру, то есть развести ионы на бесконечные расстояния.
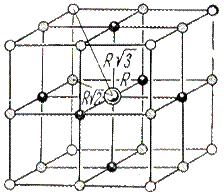
|
| Рис. 2.2. Схема структуры хлорида натрия |
Энергия решетки равна работе, которая совершается при сведении ионов из бесконечности в кристаллическую структуру:
|
|
|
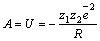 .
.
Расчет энергии решетки рассмотрим на примере. В ионном кристалле со структурой типа NaCl каждый ион окружен шестью ионами противоположного знака на расстоянии 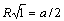 , затем окружен 12 ионами того же знака расстоянии
, затем окружен 12 ионами того же знака расстоянии 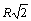 . Затем - 8 ионами противоположного знака на расстоянии
. Затем - 8 ионами противоположного знака на расстоянии 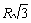 , затем - 6 ионами того знака на расстоянии
, затем - 6 ионами того знака на расстоянии 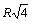 , затем - 24 ионами противоположного знака на расстоянии
, затем - 24 ионами противоположного знака на расстоянии 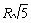 и так далее. Кулоновское взаимодействие данного иона со всем его окружением будет определяться суммой вида:
и так далее. Кулоновское взаимодействие данного иона со всем его окружением будет определяться суммой вида:

|
|
|


