 |
Первым необходимым условием проявления изоморфизма является близость размеров замещающих друг друга частиц.
|
|
|
|
Это условие сформулировано в правиле Гольдшмидта: изоморфные смеси образуются в широких пределах при температурах, лежащих далеко от точки плавления, если радиусы взаимозамещающихся структурных единиц различаются не более чем на 15 %.
Гольдшмидт относил это правило к ионным кристаллам, аналогом для металлических и ионных кристаллов можно считать правило 15 % - ной разницы атомных диаметров Юм-Розери.
Опыт показывает, что если разница атомных радиусов превышает предельное значение 15 %, существование изоморфных смесей становится весьма маловероятно, когда же эта разница меньше 15 %, то существенную роль могут приобрести другие факторы. Даркен и Гурри(1953) установили, что область наиболее благоприятная для образования изоморфных смесей ограничивается разностью электроотрицательностей ±0,4 по шкале Полинга и 15 % разницей атомных радиусов.
В изоморфной паре Mg и Fe, разница ионных радиусов, которых составляет 5 %. В железомагнезиальных минералах образуются непрерывные ряды твердых растворов (например, в оливинах Mg2SiO4 - Fe2SiO4, пироксенах MgSiO3 - FeSiO3, шпинелях MgFe2O4 - Fe3O4). Структуры этих породообразующих минералов остаются стабильными при любых количественных соотношениях Mg: Fe.
Таким образом, близость атомных радиусов является обязательным, но не достаточным условием существования изоморфных смесей. Одно из главных дополнительных условий изоморфизма близость поляризационных свойств ионов. Так, ионы, имеющие электронную оболочку благородного газа (Na+, Ca2+) не замещают или замещают с трудом ионы с 18-электронной оболочкой, даже если их размеры близки (Cu+, Hg2+).
Так, классические ионные радиусы Na+ и Cu+ практически одинаковы, и нет геометрических препятствий для взаимных замещений между этими ионами. В таких случаях причиной несмесимости, т. е. невозможности образовать твердый раствор, является разный характер химической связи в соединениях Na+ и Cu+, так как разность их электроотрицательностей составляет 0,9. И если в первом случае образуются чисто ионные связи, то во втором частично ковалентный характер связи становится весьма существенным. Подобны же причины несмесимости в твердом состоянии близких по размеру атомов Ca и Hg, Sr и Pb, K и Ag и др.
|
|
|
Другим важные правилом изоморфизма для изовалентных замещений является правило полярности Гольдшмидта: ион с меньшим радиусом будет входить в общую кристаллическую структуру легче, чем ион с большим радиусом, занимающий ту же позицию.
Например, Na+ должен охотнее замещать К+ в KCl, чем К+ будет замещать маленький Na+ в NaCl.
В случае гетеровалентных замещений действует другое правило: ион с большим зарядом входит в кристалл легче, чем ион с меньшим зарядом, занимающий ту же кристаллографическую позицию.
Например, Mg2+ может замещаться на Sc3+, а обратное замещение маловероятно.
В случае изодиморфизма большое значение имеет схожесть кристаллических структур компонентов. Например, изоморфизм Ca2+ и Sr2+ обычен для изоструктурных силикатов (полевые шпаты), фосфатов (апатиты), карбонатов, но отсутствует в природных сульфатах, поскольку гипс CaSO4?2H2O – кристаллогидрат, который имеет моноклинную структуру, а целестин SrSO4 имеет ромбическую структуру.
Важные обобщения правил изоморфизма сделал Ферсман. Он пришел к выводу, что именно в диагональных направлениях Периодической системы увеличение радиуса иона на 6 – 10 % сопровождается одновременным увеличением заряда. Это обеспечивает наиболее благоприятные условия для гетеровалентного изоморфизма. Он обосновал диагональные ряды изоморфизма, носящие его имя.

|
|
|
Стрелки в этой схеме указывают на направленность (полярность) изоморфизма.
Преимущественно диагональное направление стрелок заменяется на вертикальное, для пар Zr-Hf, Nb-Ta, Mo-W, это следствие «лантаноидного сжатия», в результате которого размеры указанных пар ионов оказываются очень близки. По этой причине гафний вообще не образует собственных минералов, а входит в соединения циркония.
В итоге Ферсман построил так называемые «звезды изоморфизма», которые показывают в обобщенной форме изоморфные связи между элементами. Для калия она имеет следующий вид:

Наиболее тесные изоморфные отношения калий обнаруживает со своими ближайшими соседями – натрием, рубидием и барием и менее прочные с более далекими – скандием, таллием, цезием, лантаноидами. Из анализа «звезд» следует правило кристаллохимической компенсации: если Ba2+ замещается на Ln3+, то лучшей компенсацией избыточной валентности является одновременное замещение другого иона бария на К+: 2Ba2+ 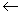 Ln3+ + K+.
Ln3+ + K+.
Таким образом, для того чтобы произошло изоморфное замещение необходимо выполнение следующих условий:
● близость атомных радиусов;
● близость размеров и форм ячеек кристаллических решеток;
● близость поляризационных свойств (сохранение типа химической связи);
● близость зарядов ионов.
Твердые растворы
В результате изоморфного замещения образуются твердые кристаллические вещества, которые называются твердые растворы. В случае полного изоморфизма образуется непрерывный ряд твердых растворов, например NaAlSi3O8 – CaAl2Si2O8 (альбит – анортит). При ограниченном изоморфизме образование твердых растворов происходит только при определенных соотношениях компонентов или при определенных условиях.
По характеру образования структуры различают: твердые растворы замещения, внедрения и вычитания.
|
|
|


