 |
Тип IV. Полиморфный переход типа смятия или сдвига
|
|
|
|
Не изменяется структурный тип и число атомов ячейке, в результате незначительных подвижек атомов изменяется симметрия ячейки при малом изменении её объема, это полиморфный переход типа сдвига смятия. Известный пример – переходы в кристаллах со структурой перовскита (а). На рисунке показан такой переход:
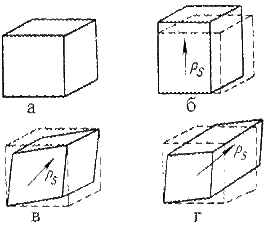
К таким превращением приводит небольшое смещение атомов в направлениях, показанных стрелками (б, в, г). В результате таких атомных сдвигов возникает спонтанная электрическая поляризация, и поэтому многие соединения с некубической структурой перовскитового типа являются сегнетоэлектриками.
| Тип | Подтип или вид | Примеры |
| I. С изменением первого координационного числа | а) реконструктивный переход (разрыв связей и полная перестройка структуры) б) дисторсионный переход (смещение атомов на небольшие расстояния) | Серое Sn  белое Sn
Графит белое Sn
Графит  алмаз
Кварц алмаз
Кварц  стишовит стишовит

|
| II. С изменением взаимного расположения координационных полиэдров (типа шаровой упаковки), КЧ сохраняется | а) реконструктивный переход (изменение типа укладки координационных полиэдров) б) дисторсионный переход (поворот отдельных атомных групп друг относительно друга) | Сфалерит  вюрцит (ZnS)
Рутил вюрцит (ZnS)
Рутил  брукит брукит  анатаз (TiO2)
Кварц анатаз (TiO2)
Кварц  кристобалит кристобалит  тридимит (SiO2) тридимит (SiO2)
 -кремнезем -кремнезем   -кремнезем -кремнезем
|
| III. Превращения, связанные с упорядочением структуры (КЧ и КП сохраняется) | а) замещение атомов и образование сверхструктур б) вращение молекул и радикалов в) электронное или магнитное упорядочение | (Cu, Au)  CuAu
колумбит FeNb2O6 CuAu
колумбит FeNb2O6  иксиолит 3(Fe, Nb)O2
парафины С29Н60, NH4NO3
магнетит Fe3O4, СоО иксиолит 3(Fe, Nb)O2
парафины С29Н60, NH4NO3
магнетит Fe3O4, СоО
|
| IV. Переход типа смятия или сдвига (не изменятся структурный тип и число атомов в ячейке) | ... | перовскиты |
| V. Изоструктурные переходы (не связаны с изменением структуры) | ... | Ce, EuO, SmS, SmSe, Fe2O3, MnS2 |
|
|
|
Фазовые переходы. К полиморфным превращениям приводят переходы первого и второго рода. Фазовые переходы первого рода сопровождаются скачком таких термодинамических функций, как энтропия, объем и т. п. Кристаллическая структура также изменяется скачком при таких переходах. К фазовым переходам первого рода относятся примеры полиморфизма I, IIa, IV, V типов. При таких фазовых переходах может не существовать никакой определенной связи между структурами исходной и конечной фаз, например: графит - алмаз.
При фазовых переходах второго рода скачок испытывают производные термодинамических функций (теплоемкость, сжимаемость, термическое расширение и т. д.). Кристаллическая структура при фазовом переходе второго рода изменяется непрерывно. К таким полиморфным превращениям относятся превращения типа III. Характерной особенностью перехода такого рода является то, что группа симметрии одной их фаз является подгруппой симметрии другой фазы. При упорядочении атомов теряются лишь некоторые из элементов симметрии, остальные остаются и образуют подгруппу. Более симметричная фаза соответствует, как правило, высокотемпературной модификации.
Политипизм (политипия) – способность одного и того же вещества кристаллизоваться в нескольких слоистых структурных модификациях, которые различаются только порядком чередования или поворотом одинаковых слоев. Размеры элементарных ячеек в плоскости слоя одинаковы для всех политипных модификаций.
Это явление открыто в 1912 году Г. Баумгауэром при изучении карбида кремния.
Политипизм иногда рассматривают как особый одномерный полиморфизм, но политипизм имеет свои физико-химические особенности. В отличие от полиморфных модификаций, для политипов невозможно указать границы их существования. Кроме того, обычно кристаллизуется смесь нескольких политипов, которые могут образовывать срастания друг с другом даже в одном монокристалле. Политипы имеют практические одинаковые физические свойства. Различные политипы ZnS приведены на рисунке, их структуры описываются в плотнейших шаровых упаковках.
|
|
|
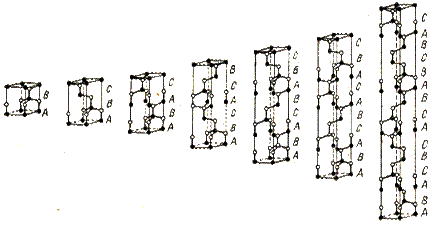
|
| Рис. 2.9. Различные политипы сульфида цинка |
Изоморфизм
Изоморфизмом (от греч. изос – равный и морфос – форма) называется взаимное замещение атомов (или групп атомов) различных химических элементов в эквивалентных позициях кристаллических структур.
Опыты по кристаллизации дали к началу XIX века тот необходимый фактический материал, который привел к открытию изоморфизма. На точную экспериментальную основу эти опыты впервые были поставлены французским химиком Н. Лебланом и петербуржским академиком Т. Ловицем. Большая часть их исследований была надолго забыта. Только Э Мичерлиху удалось сформулировать понятие изоморфизма.
Закон изоморфизма бы сформулирован в 1821 г. таким образом: одинаковые количества атомов, соединенные одинаковым способом, дают одинаковые кристаллические формы; при этом кристаллическая форма не зависит от химической природы атомов, а определяется только их числом и относительным положением.
При совместной кристаллизации веществ образуются смешанные кристаллы или изоморфные смеси. Изоморфизм широко распространен в природе, большинство минералов представляют собой изоморфные смеси сложного переменного состава. Например, в минерале сфалерит ZnS до 20 % атомов цинка могут быть замещены атомами железа. С изоморфизмом связано распространение редких и рассеянных элементов в минералах и горных породах, в которых они содержатся в виде примесей.
Классификация изоморфизма
| Изовалентный изоморфизм –взаимозамещаются ионы, имеющие одинаковую валентность | ||||
| Собственно изовалентный изоморфизм, компоненты смеси имеют одинаковые структуры | Изовалентный изодиморфизм,компоненты смеси имеют разные структуры | |||
| Гетеровалентный изоморфизм –взаимозамещаются ионы, имеющие различную валентность | ||||
| Собственно гетерогенный изоморфизм без изменения числа атомов в элементарной ячейке | Гетеровалентный изодиморфизм с изменением числа атомов в элементарной ячейке | |||
| сопряженное замещение в анионной и катионной подрешетке с одновременным изменением валентности катиона и аниона, например: ZnS – GaAs, K2BeF4 – K2SO4, KNbO3 – KMgF3. | замещение двух одинаковых атомов в эквивалентных структурных позициях на два различных атома с той же суммарной валентностью, например: 2SnO2 – FeNbO4, Fe2O3 – FeTiO3, 2PbS – AgBiS2, 2ZnS – CuFeS2. | замещение двух пар различных атомов в неэквивалентных структурных положениях с одинаковой суммарной валентностью, например: ряд плагиоклазов NaAlSi3O8 – CaAl2Si2O8 и пироксенов CaMgSi2O6 – NaFeSi2O6 | с вычитанием (образование вакансий),
например: LiCl – MgCl2
2Li+ 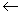 Mg2+ + Mg2+ + 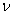 Li;
в вольфрамите FeWO4
3Fe2+ Li;
в вольфрамите FeWO4
3Fe2+  2Sc3+ + 2Sc3+ + 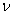 Fe.
Такие замещения приводят к образованию вакантных позиций Fe.
Такие замещения приводят к образованию вакантных позиций 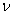 в кристаллической структуре, чтобы удовлетворить требованиям электронейтральности кристалла в кристаллической структуре, чтобы удовлетворить требованиям электронейтральности кристалла
| с внедрением (заполнением пространства),например: флюорит CaF2 с редкими землями или иттрием: Ca2+ 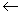 Y3+ + [F-],
где [F-] - внедренный в кубическое междоузлие ион F- Y3+ + [F-],
где [F-] - внедренный в кубическое междоузлие ион F-
|
|
|
|
Правила изоморфизма
Многочисленные исследования изоморфных веществ показывают, что образование смешанных кристаллов возможно тогда, когда замещающие друг друга частицы обладают сходным характером взаимодействия, так как только при этом условии возможна устойчивость всего кристалла.
|
|
|


