 |
Гомо- и гетеродесмичные структуры. Характер кристаллической структуры
|
|
|
|
Во многих кристаллических структурах атомы благодаря прочному химическому связыванию объединяются в устойчивые и относительно изолированные группировки, которые рассматривают как структурные единицы кристалла. Они могут переходить практически без изменений из одной кристаллической структуры в другую. Выделение структурных единиц по их кристаллохимическим и геометрическим признакам позволяют определить характерные черты строения кристалла – мотив структуры.
По характеру химической связи структуры делятся на гомодесмические (изодесмические) и гетеродесмические.
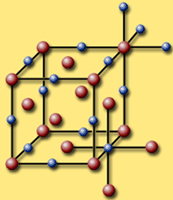
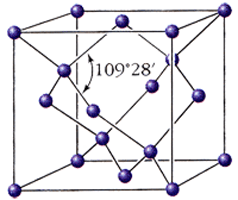
Гомодесмическими или изодесмическими (от греч. гомо – одинаковый и десмос – связь) называются структуры, в которых все атомы связаны друг с другом близкими по типу химическими связями и их координационные числа одинаковы или близки. При этом химическая связь необязательно проявляется в чистом виде, например связь в кристалле ZnS ковалентная со значительной долей ионности связи. Гомодесмические структуры имеют металлы, ионные вещества – хлорид натрия NaCl, шпинель MgAl2O4, ковалентные – алмаз С. Структурные единицы таких кристаллов – атомы или ионы, образующие трехмерную сетку приблизительно равноценных связей.
Координационные структуры состоят из атомов, равномерно распределенных по всему кристаллическому пространству, при этом атомы не образуют каких-либо группировок. Такие структуры характеризуются одинаковыми межатомными расстояниями. Примеры координационных структур: с ионной связью – хлорид натрия, фторид кальция, с ковалентной связью – алмаз, с Ван-дер-ваальсовой связью – кристаллы благородных газов, с металлической связью – магний, железо.
|
|
|
Кристаллическая структура хлорида натрия NaCl; Кристаллическая структура фторида кальция CaF2

Кристаллическая структура алмаза С Кристаллическая структура металлического магния Mg

Каркасные структуры
Каркасные структуры представляют собой трехмерную сетку из атомных группировок с достаточно большими пустотами. При этом, в случае гомодесмичной структуры, каркас валентно-нейтрален. Примером каркасной гомодесмичной структуры служат различные модификации кремнезема SiO2.
Каркасные структуры также реализуются и в гетеродесмичных кристаллах, в этом случае каркас заряжен. Межатомное расстояние в самом каркасе существенно меньше, чем расстояния между атомами каркаса и атомами-компенсаторами, вследствие различной химической связи между ними. Каркасная гетеродесмическая структура реализуется в перовските CaTiO3. В этой структуре каркас образуется из атомов титана и кислорода, связанных ковалентной связью, в пустотах каркаса располагаются атомы кальция, связанные с титан-кислородными октаэдрами преимущественно ионной связью.
Кристаллическая структура кремнезема SiO2 Кристаллическая структура перовскита CaTiO3
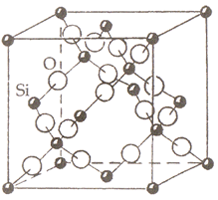

Гомодесмические структурыделятся на два основных вида: координационные и каркасные. В первых координация атомов одинакова (NaCl) или приблизительно одинакова (шпинель MgAl2O4) во всех направлениях. Во втором случае одинаковые структурные группировки образуют пространственную ажурную решетку, в которой имеются сравнительно большие пустоты (например, SiO4 – тетраэдры в кварце).
Гетеродесмическими или анизодесмическими (от греч. гетеро – разные и десмос – связь) называются структуры, в которых атомы в кристалле связаны разными типами химической связи. В таких кристаллах образуются обособленные устойчивые группировки атомов. Примеры: молекулярные органические кристаллы (внутри молекулы прочные ковалентные связи, между молекулами слабы силы Ван-дер-Ваальса), в неорганических кристаллах прочные структурные группировки составляют анионы типа SiO42-, CO32-, SO42- или молекулы СО2, I2 и другие. Эти группировки пространственно ограничены во всех трех измерениях.
|
|
|
Гетеродесмичные структуры образуют четыре типа структур: каркасные, островные, цепочечные и слоистые.
Каркасные структуры
Каркасные структуры представляют собой трехмерную сетку из атомных группировок с достаточно большими пустотами. При этом, в случае гомодесмичной структуры, каркас валентно-нейтрален. Примером каркасной гомодесмичной структуры служат различные модификации кремнезема SiO2.
Каркасные структуры также реализуются и в гетеродесмичных кристаллах, в этом случае каркас заряжен. Межатомное расстояние в самом каркасе существенно меньше, чем расстояния между атомами каркаса и атомами-компенсаторами, вследствие различной химической связи между ними. Каркасная гетеродесмическая структура реализуется в перовските CaTiO3. В этой структуре каркас образуется из атомов титана и кислорода, связанных ковалентной связью, в пустотах каркаса располагаются атомы кальция, связанные с титан-кислородными октаэдрами преимущественно ионной связью.
Островные структуры
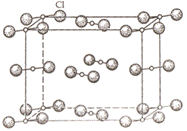
Островные структуры состоят из отдельных конечных группировок. Этими группировками могут быть молекулы или ионы. Примером островной структуры содержащей молекулы служит кристаллический хлор, где связь между атомами хлора ковалентная, а между молекулами – Ван-дер-ваальсова. В кальците CaCO3 реализуется островная структура с ионной карбонатной группировкой CO32-, в нутрии группировки связь преимущественно ковалентная, а между карбонат-ионами и ионами кальция – ионная.
Кристаллическая структура хлора Cl2
Цепочечные структуры
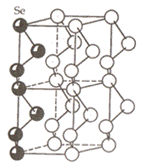
Цепочечные структуры состоят из группировок атомов, связанных в цепочки. Цепочки могут быть нейтральные и валентно-насыщенные. Примером нейтральной структуры служит структура селена, где между атомами селена в цепочке связь ковалентная, а между атомами соседних цепочек – Ван-дер-Ваальсова. Валентно-насыщенная структура реализуется в гидрокарбонате натрия, в этом случае водородные связи выстраивают гидрокарбонат-ионы в цепочки, связь между которыми осуществляется через ионы натрия.
|
|
|
Кристаллическая структура селена Se
Слоистые структуры
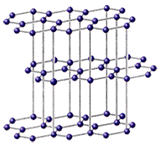
Слоистые структуры состоят из валентно-насыщенных слоев. Примером такой структуры служит графит, внутри слоя реализуется ковалентная связь, а между слоями – Ван-дер-ваальсова связь.
Кристаллическая структура графита С
Структуры, в которых отчетливо выделяются устойчивые группировки, называются островными, например ангидрит CaSO4 или кальцит CaCO3. Если островные группировки нейтральны, то образуется молекулярный кристалл. Молекулярные структуры типичны для органических кристаллов и некоторых простых неорганических веществ. Протяженность структурных группировок в отдельных направлениях характеризуется числом измерений трехмерного пространства k, в которых они ограничены. Следовательно, число m = 3 – k указывает на число измерений пространства, в которых структурные группировки бесконечны и периодичны. При k = 0, m = 3, такой кристалл можно рассматривать как гигантскую структурную группировку, по мере увеличения k и уменьшения m образуются слоистые структуры (k = 1, m = 2), цепочечные или ленточные структуры (k = 2, m = 1), и островные структуры (k = 3, m = 0).
Существуют также структуры с не четко выраженными группировками, а также группировками разного типа, они называются – гибридные структуры, в них упорядоченно чередуются слои разной химической природы.
|
|
|


