 |
Критерии устойчивости структурного типа
|
|
|
|
Ионные кристаллы. На основании обобщения экспериментального материала Лаймус Полинг в 1928 г. вывел пять правил строения ионных кристаллов, которым подчиняются стабильные структуры ионных кристаллов:
- расстояние катион – анион в координационном полиэдре определяется суммой ионных радиусов, а координационное число их отношением;
- сумма валентных усилий катионов, сходящихся на анионах, должна быть численно равна или почти равна валентности аниона;
- устойчивость структуры снижается при наличии общих граней и ребер координационных полиэдров;
- высоко ковалентные и особенно маленькие по размеру катионы стремятся не иметь общих анионов;
- число разных по конституции структурных фрагментов стремится к минимуму.
Первое правило. Суммирует более раннее правила Магнуса (1922) и Полинга (1926), согласно которым КЧ катиона определяется тем отношением его радиуса к радиусу аниона, при котором наступает соприкосновение между собой и «расталкивание» соседних анионов. Эти соотношения, вычисленные из геометрических соображений, приведены в таблице для разных КЧ.
| КЧ | КП | r+/r- | g = R/r- |
| Кубооктаэдр | 1,000 | 2,000 | |
| Центрированная по вертикальным граням тригональная призма | 0,732 | 1,732 | |
| Куб | 0,732 | 1,732 | |
| Квадратная антипризма | 0,645 | 1,645 | |
| Октаэдр с одной центрированной гранью | 0,592 | 1,592 | |
| Октаэдр | 0,414 | 1,414 | |
| Тетраэдр | 0,215 | 1,215 | |
| Треугольник | 0,155 | 1,155 |
R – расстояние от центра полиэдра до его вершины (т. е. расстояние катион – анион), r - равно половине ребра полиэдра, т.е. расстояние анион – анион. Ясно, что значение g не зависит от выбора эффективных ионных радиусов. Это правило показывает, что значение КЧ уменьшается с уменьшением отношения r+/r-, хотя «критические значения» не всегда имеют четкие границы. Объяснение этого несоответствия заключается в том, что многие кристаллы стабилизируются высокой долей ковалентности химической связи.
|
|
|
Второе правило Полинга – электростатическое правило валентностей – позволяет наиболее рационально распределить в структуре атомы разной валентности. Оно требует, чтобы в стабильной структуре соблюдался локальный баланс валентностей, то есть сумма валентных усилий (отношение валентности атома к его координационному числу) всех ближайших соседей данного атома была бы равна или приблизительно равна его собственной валентности. Математически второе правило Полинга записывается следующим образом:

z- - заряд аниона, vi – валентное усилие i – катиона, равное отношению его заряда к КЧ.
Для многих простых и даже довольно сложных структур это правило выполняется точно. Рассмотрим его на примере перовскита CaTiO3. Ион О2- в структуре перовскита окружен двумя ионами Ti4+ (КЧ = 6) и четырьмя ионами Са2+ (КЧ = 12), валентные усилия которых равны:

что точно соответствует заряду аниона кислорода.
Это правило сильно ограничивает число приемлемых для данного вещества структур, оно служит для контроля правильности определения структур и строго применимо только для правильных координационных полиэдров, для искаженных структур возможно заполнение позиций с отклонением меньшими 10-20 %.
Хотя свое второе правило Полинг отнес к ионным кристаллам, условие локального баланса валентностей выполняется и для ковалентных кристаллов. Например, для сфалерита (сульфида цинка) с тетраэдрической конфигурацией обоих атомов:

что равно валентности серы, как требует правило. В данном случае более правильно использовать не валентное усилие катиона, а кратность ковалентной связи.
Третье и четвертое правило тесно связаны между собой, и показывают, что появление общих ребер и особенного граней координационных полиэдров приводит к сильному уменьшению расстояний между катионами, находящихся в их центрах. Так, расстояния между центрами октаэдров с общими вершинами, ребрами и гранями относятся как 1: 0,71: 0,58, а тетраэдров соответственно 1: 0,53: 0,33. При таком сильном сближении возрастают силы отталкивания между катионами, что делает структуру неустойчивой. По этой причине тетраэдры SiO4 связываются между собой только вершинами, а более крупные TiO6 – октаэдры могут иметь по два (рутил), три (брусит) и четыре (анатаз) общих ребра, но рутил является самой устойчивой модификацией TiO2.
|
|
|
Если КП вокруг катионов с большим зарядом все-таки вынуждены иметь общие ребра или грани, то отталкивание между ними ведет к деформации КП, при которой расстояние между катионами было бы как можно больше. Это достигается за счет уменьшения длины общих ребер КП.
Эти правила Полинга относятся только к КП вокруг ионов с заполненной оболочкой типа инертного газа. Незаполненные оболочки ионов переходных металлов оставляют возможности для металл-металл валентных взаимодействий, которые становятся более эффективными при сближении катионов друг с другом, поэтому многие переходные металлы кристаллизуются в структуре типа NiAs, в которой октаэдры вокруг атомов металла имеют общие грани.
Пятое правило – правило экономичности – утверждает, что число различных структурных элементов в одной кристаллической структуре, стремится быть небольшим. Это позволяет сконструировать устойчивые группировки КП, называемые вторичными структурными элементами, из которых можно построить большое семейство кристаллических структур. На рисунке показаны сочетания кремнийкислородных тетраэдров (точками обозначены центры тетраэдров, цифрами – число тетраэдров, составляющих структурную единицу), которые служат вторичными структурными элементами при сборке молекулярных сит – цеолитов.

|
| Рис. 2.10. Вторичные структурные элементы, выделенные в каркасах цеолитов. |
На втором рисунке показано, как из другой вторичной структурной единицы, названной «содалитовым фонарем», собираются кристаллические структуры цеолитовых минералов.
|
|
|
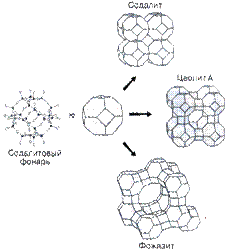
|
| Рис. 2.11. Построение структур некоторых цеолитов из содалитового фонаря. |
Знание вторичных структурных единиц позволяет предсказывать новые структуры.
Ковалентные кристаллы. Для ковалентных кристаллов, в отличие от ионных, ведущим фактором устойчивости структуры становится направленность химических связей, которая обуславливает как КЧ, так и геометрическую конфигурацию ближайшего окружения. В качестве меры направленного характера химической связи между атомами используют среднее главное квантовое число  самых наружных занятых электронных оболочек. С увеличением
самых наружных занятых электронных оболочек. С увеличением  атомные орбитали, участвующие в образовании связей, и сами связи постепенно теряют свою направленность. Это свойство зависит не только от
атомные орбитали, участвующие в образовании связей, и сами связи постепенно теряют свою направленность. Это свойство зависит не только от  , но и от разности электроотрицательностей атомов
, но и от разности электроотрицательностей атомов  . По мере возрастания
. По мере возрастания  связи становятся более ионными, т.е. ненаправленными, вне зависимости от величины
связи становятся более ионными, т.е. ненаправленными, вне зависимости от величины  .
.
Для простых ковалентных веществ справедливо правило Юма-Розери: в структурах простых ковалентных веществ (IV-VI групп Периодической системы) КЧ равно 8 – N, где N – номер группы.
Для бинарных соединений МХ с существенно ковалентной связью выполняется правило Гримм-Зоммерфельда, которое в общей форме выражается как  , где ne – число валентных электронов, а m – число атомов на формулу соединения. Отношение
, где ne – число валентных электронов, а m – число атомов на формулу соединения. Отношение  называют «концентрацией валентных электронов».
называют «концентрацией валентных электронов».
Дальнейшим обобщением правила октета для существенно ковалентных соединений типа MkXl является правило Музера-Пирсона:
 ,
,
где l – число анионов, b – число связей, образуемых между одноименными атомами. Например, в тетрагональной фазе ZnP2 имеется спиральные цепочки из атомов Р. Следовательно, каждый атом Р связан с двумя другими и b = 2 (каждая связь принадлежит данному атому наполовину). Правило выполняется при ne = 12, l = 2.
Обобщенному правилу Пирсона для сложных соединений можно придать следующий вид:

ne – сумма валентных электронов всех атомов в химической формуле соединения, nXX – число электронов, участвующих в связи анион - анион, nMM - число электронов, образующих связи катион – катион или остающихся в неподеленных парах. Например, в галените PbS из четырех валентных электронов свинца 2 остаются в качестве неподеленной электронной пары. Значит ne = 6 + 4 = 10, nXX = 0, nMM = 2, l = 1, и правило октета выполняется.
|
|
|
Дефекты в кристаллах
Идеальных кристаллов не существует. Все они содержат те или иные дефекты. Под действием внешних воздействий в процессе роста кристалла нарушается правильное расположение атомов, или его химический состав отклоняется от стехиометрического состава. Все это приводится к изменению свойств кристалла, но далеко не всегда в худшую сторону.
По характеру нарушения расположения структурных единиц в кристаллической структуре дефекты делятся на:
- точечные (нульмерные), размеры дефектов сравнимы с межатомными расстояниями;
- линейные (одномерные), дефекты вдоль линии макроскопической длины;
- поверхностные (двухмерные), дефекты на поверхности кристалла;
- искажения кристаллической решетки (трехмерные).
|
|
|


