 |
В. Методы диагностики
|
|
|
|
Таблица 1. Имеющиеся методы тестирования для диагностики ящура и их цель
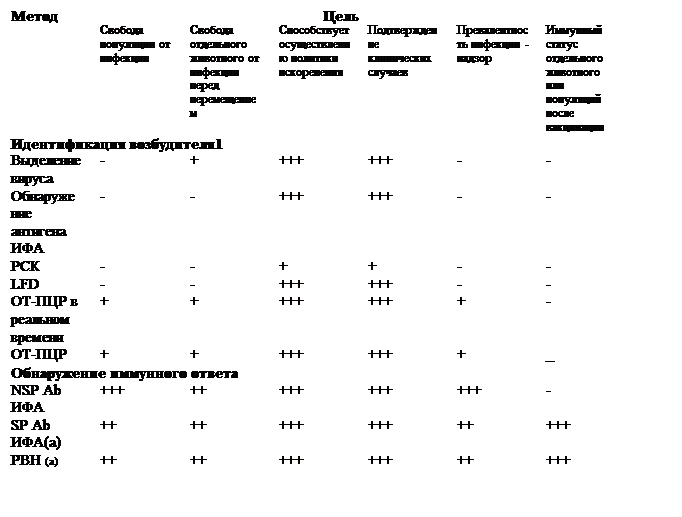
1 Рекомендуется использовать комбинацию методов идентификации при исследовании одного и того же клинического образца.

Пояснения: +++ = рекомендуемый метод, валидированный для указанной цели; ++ = подходящий метод, но может потребоваться дополнительная валидация; + = может быть использован в некоторых ситуациях, но стоимость, достоверность или другие факторы серьезно ограничивают его применение; - = не соответствует указанной цели; n/a- не применим.
ИФА =иммуноферментный анализ; РСК = реакция связывания комплемента; LFD= устройство бокового потока; ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией; AGID= иммунодиффузия в агаровом геле; NSP Ab ИФА = ИФА для обнаружения антител к неструктурным белкам вируса; SP Ab ИФА = ИФА для обнаружения антител к структурным белкам вируса РВН- реакция вируснейтрализации
(а) Данный тест не дифференцирует инфицированных и вакцинированных животных
Для проведения лабораторной диагностики, предпочтение отдается эпителию или везикулярной жидкости. В идеале, необходимо собрать, как минимум, 1 г. эпителиальной ткани из не разорвавшейся или только что разорвавшейся везикулы, обычно с языка, со слизистой оболочки щеки или нижних конечностей. Для того чтобы во время сбора образцов избежать нанесения травм персоналу, который занимается отбором образцов, а также в целях обеспечения благополучия животных, перед взятием образца рекомендуется успокоить животных, применяя седативные средства.
Эпителиальные образцы следует поместить в транспортную среду, состоящую из равных количеств глицерина и 0, 04 М фосфатного буфера, pH 7, 2-7, 6, предпочтительно с добавлением антибиотиков (пенициллин [1000 международных единиц (МЕ)], сульфат неомицина [100 МЕ], сульфат полимиксина В [50 МЕ], микостатин [100 МЕ]). При отсутствии 0, 04 М фосфатного буфера, вместо него можно использовать среду для культивирования тканей или забуференный фосфатом солевой раствор (ЗФР), но важно, чтобы итоговый рН уровень смеси глицерин/буферный раствор находился в пределах pH 7, 2-7, 6. Вирус ящура чрезвычайно изменчив при низком рН, поэтому забуферивание транспортной среды крайне важно для успешного отбора образцов. Образцы, до тех пор, пока они не будут доставлены в лабораторию, следует хранить в холодильнике или на льду.
|
|
|
Когда невозможно получить эпителиальную ткань от жвачных животных, например, при запущенных случаях болезни или в период выздоровления, или когда имеются подозрения о наличии инфекции при отсутствии клинических признаков, можно отбирать образцы пищеводно-глоточной жидкости при помощи пищеводно-глоточного зонда (или у свиней мазок из зева) для предоставления в лабораторию с целью проведения процедуры выделения вируса или полимеразной цепной реакции с обратной транскрипцией. Во время исследования образцов сыворотки крови посредством полимеразной цепной реакции с обратной транскрипцией или процедуры выделения вируса также можно обнаружить вирусемию. Для взятия мазка из зева у свиней, животное укладывают на спину на деревянное ложе и удерживают на нем с вытянутой шеей. Захватив тампон соответствующим инструментом, таким как артериальный зажим, тампон проталкивают к задней стенке ротовой полости и в глотку.
Перед сбором пищеводно-глоточных образцов у КРС или у крупных жвачных животных (например, у буйволов), 2 мл транспортной жидкости (состоящей из 0, 08 М фосфатного буфера, содержащего 0, 01% альбумина бычьей сыворотки, 0, 002% фенолового красного, антибиотиков [100 ед/мл пенициллина, 100 ед/мл микостатина, 100 ед/мл неомицина и 50 ед/мл полимиксина], и доведенной до уровня рH 7, 2) следует поместить в сосуд, емкостью около 5 мл, способный выдерживать заморозку на сухом льду (твердый диоксид углерода) или в жидком азоте (Kitching and Donaldson, 1987).
|
|
|
Отбор образцов пищеводно-глоточной жидкости производится посредством введения пищеводно-глоточного зонда над языком в ротоглоточную полость, а затем, энергичного
его перемещения вперед и назад от 5 до 10 раз между первой частью пищевода и задней частью глотки. Целью данной процедуры является сбор пищеводно-глоточной жидкости и особенно поверхностных эпителиальных клеток с этих участков, включая проксимальную часть пищевода, стенки глотки, тонзиллярные ниши и поверхности мягкого неба. Если образец не содержит необходимого количества клеточного дебриса, процедуру можно повторить.
После сбора пищеводно-глоточной жидкости с помощью зонда, содержимое чаши следует вылить в прозрачный сосуд с широким горлышком, вместительностью около 20 мл. Жидкость исследуют, и она должна содержать какое-то количество клеточного материала, видимого невооруженным глазом. Затем в эту жидкость добавляют транспортную жидкость приблизительно в таком же объеме, добиваясь переноса клеточного материала; смесь осторожно встряхивают, и её итоговый уровень pH должен составлять приблизительно 7, 6. Образцы, контаминированные содержимым желудка, могут быть непригодными для культивирования. Образцы, в которых видно присутствие крови, не являются полностью приемлемыми. Повторный отбор образцов может быть произведен после ополаскивания рта и глотки животных водой или забуференным фосфатом солевым раствором. При отборе образцов от нескольких животных, необходимо производить очистку и дезинфекцию пищеводно-глоточного зонда после его использования у каждого животного. Зонд промывают водопроводной водой, погружая его в подходящее дезинфицирующее средство (например, 0. 5% [вес/объем] лимонной кислоты в водопроводной воде), а затем смывают все дезинфицирующее средство водой, перед тем как данный зонд будет использован для отбора образцов у следующего животного.
Для того, чтобы собрать образцы пищеводно-глоточной жидкости у мелких жвачных животных, в сосуд с широким горлышком, вместимостью около 20 мл, помещают 2 мл транспортной жидкости, а затем, после отбора образцов зонд промывают транспортной жидкостью, чтобы слить образец пищеводно-глоточной жидкости. Затем эту смесь переливают в сосуд вместимостью около 5 мл для последующей транспортировки. Такой небольшой сосуд должен выдерживать заморозку на сухом льду или в жидком азоте (Kitching and Donaldson, 1987).
|
|
|
Образцы пищеводно-глоточной жидкости сразу после отбора должны быть помещены в холодильник или заморожены. Если их предстоит транспортировать дольше, чем несколько часов, то их лучше заморозить, поместив либо на сухой лед, либо в жидкий азот. Перед замораживанием емкости должны быть тщательно запечатаны либо с помощью воздухонепроницаемой навинчивающейся крышки, либо с помощью силикона. Это особенно важно при использовании сухого льда, в связи с тем, что попадание двуокиси углерода (СО2) в пищеводно-глоточную жидкость понизит ее уровень рН, инактивируя любой вирус ящура, который может присутствовать в образцах. Не следует использовать стеклянные сосуды, поскольку существует риск того, что они могут взорваться при размораживании в случае попадания в них жидкого азота. Образцы необходимо доставить в лабораторию в замороженном состоянии или, если это невозможно, их перевозка должна производиться в условиях обеспечения наличия надежной холодовой цепи.
При пересылке скоропортящихся материалов с подозрением на ящур в пределах страны, так и за ее пределы, необходимо соблюдать особые меры предосторожности. Правила перевозки опасных грузов (DGR) Международной ассоциации воздушных перевозок (IATA) содержат ясные требования относительно упаковки и отправки диагностических образцов любыми видами коммерческого транспорта. Данные требования кратко изложены в Главе 1. 1. 2 Отбор и отправка диагностических образцов и Главе 1. 1. 3.
Транспортировка образцов животного происхождения. Формы и указания по доставке образцов и спецификации для изготовления пищеводно-глоточных зондов можно найти на веб-сайте Референтной лаборатории МЭБ в Пирбрайте: http: //www. wrlfmd. org/. Процедуру отбора образцов и отправки полевых образцов для диагностики везикулярных болезней и для их дифференциальной диагностики можно найти на веб-сайте Панамериканской Референтной лаборатории МЭБ по ящуру: http: //www. panaftosa. org. br.
|
|
|


