|
Этапы функционирования нейтрофилов как клеточных эффекторов острого воспаления 1 страница
|
|
|
|
Глава 9
ПАТОФИЗИОЛОГИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Angina pectoris (стенокардия, грудная жаба) - это длительные тупая боль или ощущение сдавления, локализованные преимущественно в области сердца. Зона распространения angina pectoris в данной области сравнима с площадью поверхности сжатого кулака. Грудная жаба может иррадиировать в шею, челюстно-лицевую область, в левые руку и предплечье. Нередко angina pectoris иррадиирует в область живота. Чаще всего грудную жабу вызывают отрицательный эмоциональный стресс, физическая нагрузка, или она возникает при употреблении пищи.
Angina pectoris как симптом всегда свидетельствует о неудовлетворенной потребности сердца в свободной энергии, что чаще всего связано с обструкцией кровотоку по венечным артериям. Наиболее частая причина обструкции - это фиксированный стеноз венечной артерии вследствие ее атероскле- ротических поражений. Если сужения просвета венечных артерий, обусловленного атеросклерозом, не выявляют, то циркуляторная гипоксия (ишемия) миокарда может быть следствием других причин (табл. 9. 1).
Выделяют грудную жабу (стенокардию), которую вызывает физическая нагрузка. Физическая нагрузка увеличивает потребность организма в кислороде и энергопластических субстратах, что повышает их системный транспорт через увеличение минутного объема кровообращения, которое
Таблица 9. 1
Наиболее частые причины стенокардии
Заболевания и патологические состояния, сужающие венечные артерии:
- атеросклероз
-спазм венечных артерий -васкулит
Врожденные и приобретенные сердечные пороки:
- аортальные стеноз и недостаточность
- митральные стеноз и недостаточность -стеноз легочной артерии Кардиомиопатии
|
|
|
Гипертрофия миокарда в стадии декомпенсации Артериальная гипертензия
Сердечные аритмии (в особенности суправентрикулярная тахикардия)
Генетически обусловленные сужение просвета венечных артерий и гипоксия миокарда:
-врожденные аномалии сердечных артерий -цианотические врожденные пороки сердца
- коарктация аорты невозможно без адаптивной тахикардии. Тахикардия - это основная детерминанта роста потребности сердца в кислороде. При физической нагрузке весьма значителен рост потребности сердца в кислороде под влиянием увеличения частоты сердечных сокращений. При этом возможность увеличения доставки 02 кардиомиоцитам у больных ишемической болезнью сердца ограничена из-за фиксированного атеросклеротическим поражением стеноза венечных артерий. В результате возникает несоответствие между потребностью сердца в кислороде и доставкой его кардиомиоцитам, которое проявляет себя angina pectoris. Грудная жаба при этом выступает не только признаком, но и звеном патогенеза циркуляторной гипоксии сердца.
У многих больных ишемической болезнью сердца патологическая реакция на физическую нагрузку в частности заключается в росте общего периферического сосудистого сопротивления. Это повышает работу левого желудочка по преодолению его постнагрузки и обуславливает стенокардию у больных с атеросклеротическим стенозом венечных артерий, у которых доставка кислорода кардиомиоцитам не может возрасти адекватно росту потребности сердца в Ог Рост общего периферического сосудистого сопротивления (ОПСС) оценивают косвенно, ориентируясь на уровень диастолического артериального давления, находящийся с ОПСС в прямой связи. Для каждого больного определяют уровни («пределы») частоты сердечных сокращений и среднего артериального давления, превышение которых при физической нагрузке ведет к циркуляторной гипоксии (ишемии) сердца.
|
|
|
Грудная жаба этого типа обычно беспокоит больных в течение 1-5 мин после прекращения нагрузки. Вторичной по отношению к циркуляторной гипоксии миокарда кардиомиопатии при этом виде стенокардии не развивается. Дисфункция сердца, связанная с его циркуляторной гипоксией, в этом случае возникает только при физической нагрузке.
Степень стенокардии (циркуляторной гипоксии, ишемии сердца), вызываемой физической нагрузкой, позволяют оценить классификации нью- йоркской сердечной ассоциации (NYHA) и канадского сердечно-сосудисто- го общества (CCS) (табл. 9. 2).
Грудная жаба, от которой больные страдают в условиях покоя, - это или следствие полной обтурации просвета венечных артерий атеросклеротическими бляшками, или это стенокардия, вызванная спазмом венечной артерии на протяжении участка, просвет которого сужен вследствие атеросклероза. Нередко angina pectoris в условиях покоя возникает у больных с аортальным стенозом. Причиной грудной жабы в данном случае выступает снижение доставки кардиомиоцитам левого желудочка кислорода и источников свободной энергии при гипертрофии миокарда в стадии декомпенсации.
В последние годы у больных все чаще выявляют циркуляторную гипоксию (ишемию) миокарда, которая не проявляется стенокардией, но ведет к сердечной недостаточности. Первым симптомом сердечной недостаточности, обусловленной ишемической болезнью сердца без грудной жабы, выступает повышенная утомляемость, к которой может присоединиться одышка. Стенокардии у таких больных часто нет среди симптомов болезни и тогда, когда внезапное развитие кардиогенного шока, отека легких высокого дав-
| Таблица 9. 2 Классификации степени тяокести циркуляторной гипоксии миокарда (функциональных классов стенокардии)
|
|
|
|
ления и нарушений сердечного ритма осложняет течение ишемической болезни сердца Безболевую (немую) циркуляторную гипоксию сердца с помощью специальных методов исследований выявляют при обследовании больных, не предъявляющих жалобы на грудную жабу. Эпизоды безболевош обострения циркуляторной гипоксии (ишемии) миокарда фиксируют у 2, 5 % мужчин среднего возраста без жалоб, свидетельствующих о развитии сердечной недостаточности, и приступов стенокардии в анамнезе (первый тип без- болевой ишемии миокарда). У 40 % больных ишемической болезнью сердца, которая проявляет себя грудной жабой, при непрерывной регистрации электрокардиограммы также периодически выявляют приступы безболевой ишемии. В этой группе безболевая ишемия указывает на повышенный риск инфаркта миокарда. Предположительно в основе безболевой ишемии миокарда лежит генетически обусловленная недостаточность ноцицепторов, стимулом для которых служит недостаток кислорода в сердце и кардиомиоцитах.
Нестабильная стенокардия - это синдром, который характеризуют:
♦ грудная жаба, возникшая впервые;
♦ angina pectoris в условиях покоя;
♦ стенокардия при минимально интенсивной физической нагрузке;
♦ нарастание частоты, интенсивности и продолжительности приступов стенокардии.
Морфопатогенез нестабильной стенокардии состоит в разрыве или расщеплении атеросклеротической бляшки с образованием тромба, чему способствуют спазм ветви венечной артерии и активация тромбоцитов в ее просвете.
|
|
|
У части больных нестабильную стенокардию вызывают: а) недостаточная доставка кислорода клеткам сердца из-за падения кислородной емкости крови вследствие анемии; б) рост потребности сердца в кислороде при преодолении патологически высокой постнагрузки левым желудочком у больных с артериальной гипертензией. У 10—20 % больных с нестабильной стенокардией течение ишемической болезни сердца осложняет инфаркт миокарда. В этой связи нестабильную стенокардию следует рассматривать как показание к неотложной госпитализации больного.
Спонтанная стенокардия (стенокардия Принцметала) - это стенокардия, возникающая в условиях покоя в результате спазма венечной артерии. При стенокардии Принцметала циркуляторная гипоксия миокарда проявляет себя временным подъемом сегмента Б-Т электрокардиограммы без последующего развития инфаркта миокарда. Спазм венечной артерии чаще возникает в ее суженных атеросклерозом участках предположительно в силу большей чувствительности пораженной части к сосудосуживающим влияниям. Если спазм венечной артерии, приводящий к стенокардии данного вида, происходит в интактных сосудах, то прогноз более благоприятен. Через циркуляторную гипоксию кардиомио- цитов спазм венечной артерии может привести к сердечным аритмиям, вентрикулярным и суправентрикулярным тахикардиям и атриовентрикулярной блокаде. У небольшой части больных спазм венечной артерии при стенокардии Принцметала служит причиной инфаркта миокарда и внезапной сердечной смерти.
Сила сокращений сердечной мышцы находится в прямой связи с содержанием ионизированного кальция в цитоплазме кардиомиоцитов ([Са2+]). Высокие значения [Са2+] индуцируют сокращение кардиомиоцитов, а снижение концентрации ионизированного кальция в цитозоле ведет к расслаблению саркомеров миокарда. В конце систолы связанное с утилизацией свободной энергии (активное) функционирование ионных насосов перемещает ионизированный кальций обратно из цитозоля в саркоплазматический ретикулум. В результате снижается [Са2+], и сердечная мышца расслабляется. Патологический рост отношения потребности сердца в кислороде к доставке 02 в клетки сердца ведет к дефициту в кардиомиоцитах свободной энергии, то есть их гипоэргозу. Гипоэргоз кардиомиоцитов снижает активное возвращение ионизированного кальция в саркоплазматический ретикулум. Это обуславливает сохраняющееся в диастолу сокращение саркомеров миокарда желудочков, вызывая их диастолическую жесткость. Патологическая ригидность стенки желудочков в диастолу, обусловленная гипокси- ческой контрактурой саркомеров миокарда, повышает давление крови, которую желудочек содержит в конце диастолы. При этом не растет конечнодиастолический объем. Это приводит к диастолической левожелудочковой недостаточности, ко вторичной легочной венозной гипертензии и кардио- генному отеку легких (крайняя стадия развития левожелуцочковой недостаточности).
|
|
|
Патологический рост соотношения между потребностью сердца в кислороде и доставкой ему кислорода через гипоэргоз кардиомиоцитов угнетает активные сокращение и расслабление желудочков и вызывает систолическую и диастолическую сердечную недостаточность.
Нормальный систолический компонент насосной функции левого желудочка сердца необходимым условием имеет аэробное биологическое окисление в кардиомиоцитах выше определенного уровня интенсивности. Падение интенсивности аэробного биологического окисления вследствие циркуляторной гипоксии ниже этого уровня через гипоэргоз сократительных кардиомиоцитов быстро приводит к падению ударного объема и фракции изгнания левого желудочка сердца, вызывая систолическую сердечную недостаточность.
Потребность сердца в кислороде находится в прямой связи с величиной детерминант потребления сердцем кислорода, к которым относят:
♦ частоту сердечных сокращений (ЧСС),
♦ сократимость миокарда,
♦ напряжение стенки желудочков при сокращении.
При каждом сокращении сердце утилизирует относительно фиксированное количество кислорода. Поэтому потребление сердцем кислорода за минуту и потребность сердца в кислороде растут при возрастании частоты пульса. При росте ЧСС в два раза потребность сердца в кислороде растет в большей степени. Степень роста потребности миокарда в 02 преобладает над степенью вызвавшего его роста ЧСС, так как увеличение частоты пульса повышает сократимость сердца. В результате рост потребности сердца в кислороде начинает определять не только тахикардия, но и увеличение сократимости.
Напряжение стенки желудочков при сокращении миокарда их стенок (Б) зависит от давления крови в желудочке во время сокращения (постнагрузка, Р), от размеров камеры сердца (преднагрузка), то есть от ее радиуса (Я) и толщины ее стенки (Ь). В соответствии с законом Лапласа, напряжение стенки желудочка представляет собой прямую функцию радиуса полости желудочка и давления в ней крови. 8 растет по мере увеличения давления крови в желудочке в фазу изгнания, а также возрастает при неизменном давлении в сердечной камере вследствие роста ее радиуса. Если для лучшего понимания и разумного упрощения форму камеры желудочка сердца считать шаром, то: 8 = РЯ / 2Ь.
Увеличение давления в сердечной камере в фазу изгнания в два раза вызывает двухкратный рост потребности ее миокарда в кислороде через удвоение 8. Р - это прямая функция среднего артериального давления. Поэтому рост среднего АД может повышать соотношение между потребностью сердца в кислороде и доставкой кардиомиоцитам 02. Такой рост потребности миокарда в кислороде может служить причиной гипоэргоза клеток сердца и прогрессирования сердечной недостаточности у больных ишемической болезнью сердца. Поэтому целью интенсивной терапии сердечной недостаточности может служить снижение среднего артериального давления, которое не приводит к опасному падению перфузионного давления миокарда и через снижение 8 снижает потребность сердца в кислороде.
Увеличение объема камеры сердца в два раза увеличивает ее радиус всего на 26 %. Поэтому увеличение размеров желудочка само по себе в меньшей степени влияет на потребность сердца в кислороде, чем рост Р. Тем не менее, экцентрическая гипертрофия желудочка в стадии декомпенсации может приводить к большему росту потребности миокарда в 02, чем тот, который можно ожидать, ориентируясь только на увеличение радиуса желудочка. Дело в том, что дилатация желудочка через увеличение объема крови, который сердечная камера содержит в конце диастолы, увеличивает Р. В результате потребность миокарда в кислороде повышают как увеличение Я, так и рост Р.
Возрастание преднагрузки через увеличение конечно-диастоличесого давления повышает Р и, увеличивая конечно-диастолический объем крови в желудочке, обуславливает рост Я. В результате рост преднагрузки может вызвать опасный рост 8. Поэтому снижение общего венозного возврата, которое не приводит к артериальной гипотензии и снижению перфузионно- го давления миокарда, можно считать целью терапии у больных ишемической болезнью сердца. Такое снижение общего венозного возврата, снижая преднагрузку, уменьшает 8 и потребность сердца в кислороде. В этом в частности и заключается желательный эффект на сердце нитроглицерина, применяемого крайне осторожно, дабы не вызвать острой артериальной гипотензии.
Биологический смысл гипертрофии стенки желудочка заключается в том, что утолщение стенки снижает ее напряжение и потребность сердца в кислороде. Гипертрофия миокарда как защитная реакция в ответ на рост напряжения стенки желудочка в фазу изгнания эффективна лишь до развития вторичной по отношению к гипертрофии кардиомиопатии, вследствие которой в клетках сердца падает эффективность биологического окисления. Кроме того, при вторичной кардиомиопатии такого происхождения гипоэр- гоз клеток сердца обусловлен снижением доставки к ним кислорода, которую ограничивает недостаточность капиллярной сети гипертрофированного миокарда.
Единственный механизм удовлетворения возросшей потребности сердца в кислороде - это рост объемной скорости кровотока по венечным артериям.
Объемная скорость кровотока по венечным артериям представляет собой обратную функцию общего сосудистого сопротивления в системе венечных артерий (Яс). Яс в свою очередь зависит от соотношений эффектов на уровне сосудистой стенки ряда регуляторных влияний.
При росте работы сердца по изгнанию крови из желудочков в нем происходит накопление молочной кислоты и протонов, расширяющих венечные артерии небольшого диаметра. Кроме того, вследствие падения напряжения кислорода в цитозоле и связанного с ним гипоэргоза кардиомиоцитов происходит усиленный распад аденозинтрифосфата, и в клетках сердца растет содержание аденозина. Аденозин расширяет венечные артерии, их мелкие ветви и микрососуды сердца. В результате падение Яс увеличивает доставку кислорода кардиомиоцитам. Следует заметить, что при фиксированном стенозе венечных артерий вследствие атеросклероза этот механизм ауторегуляции неэффективен, и любой рост потребности сердца в кислороде опасен развитием циркуляторной гипоксии миокарда, так как не приводит к снижению Яс через аккумуляцию протонов и аденозина.
Стенка венечных артерий и сердечных артериол содержит альфа- и бета- адренорецепторы. Альфа-адренергическая стимуляция стенки венечных артерий может приводить к их спазму, несмотря на противодействие метаболических факторов регуляции Яс. Это чаще всего происходит в условиях покоя, когда действие метаболических факторов можно считать невысоким по интенсивности. По мере нарастания содержания в клетке протонов и аденозина, связанного с увеличением работы сердца, действие метаболических факторов регуляции сопротивления венечных артерий начинает преобладать над эффектом нервных альфа-адренергических сосудосуживающих влияний. Нервная альфа-адренергическая стимуляция стенки венечных артерий как компонент патологической стрессорной реакции может обуславливать циркуляторную гипоксию миокарда вплоть до ишемии и цитолиза кардиомиоцитов (стенокардия Принцметала). Наиболее частая причина необратимых ишемических повреждений миокарда вследствие нейрогенной констрикции венечных артерий - спазм сосуда в области его атеросклеротического поражения.
Нельзя исключить и значение в развитии спазма венечных артерий действия на них таких «сгрессорных гормонов» как вазопрессин и ангиотензины.
Свою роль в ауторегуляции сопротивления венечных артерий играет простагландиновая система их эндотелия (тромбоксан, простациклин, другие производные арахидоновой кислоты). Тромбоксан, повышая тромбогенный потенциал микрососудов сердца, вызывает их спазм при инфаркте миокарда и циркуляторной гипоксии сердца, а действие простациклина противодействует этим эффектам. Соотношение действий тромбоксана и простациклина во многом определяет состояние периферического кровообращения на уровне сердца.
В миокарде человека соотношение между кардиомиоцитами и капиллярами составляет 1: 1. В условиях покоя функционируют 3/5- 4/5 всех капилляров сердца. Рост потребности сердца в кислороде мобилизует резерв капилляров, и Яс падает. Кроме того, мобилизация резервов капилляров снижает путь диффузии кислорода из просвета микрососудов к митохондриям кардиомиоцитов, что увеличивает транспорт кислорода в клетки сердца. При гипертрофии миокарда в стадии декомпенсации эффективность данной компенсаторно-приспособительной реакции падает, и рост потребности сердца в кислороде усиливает циркуляторную гипоксию сердца.
В системе венечных артерий и микроциркуляции сердца есть множество коллатералей, которые не функционируют в условиях покоя. При обструкции вследствие атеросклеротического поражения венечной артерии кровоток по коллатералям предотвращает необратимые ишемические повреждения миокарда. Дозированная физическая нагрузка, несмотря на развитие атеросклероза венечных артерий, может увеличить степень возрастания объемной скорости кровотока по коллатералям в ответ на рост соотношения между потребностью сердца в кислороде и доставкой 02 кар- диомиоцитам.
Яс представляет собой линейную функцию вязкости крови. Обезвоживание повышает вязкость крови через увеличение гематокрита. Если больным гипертонической болезнью, страдающим от циркуляторной гипоксии миокарда, назначают мочегонные средства, то существует опасность ятро- генного снижения доставки кардиомиоцитам кислорода. Его причина - избыточное мочеотделение, вызывающее эксикоз и рост гематокрита. Гипотермия повышает вязкость крови и Яс, снижает доставку 02 клеткам сердца. В этой связи искусственную гипотермию у кардиохирургических больных считают показанием к гемодилюции, снижающей вязкость крови. В остром периоде тяжелой раневой болезни, гемодилюция, оптимизируя реологические свойства крови и снижая ее вязкость, повышает доставку кислорода к кардиомиоцитам сердца, страдающего от острой нейродистрофии. Снижение вязкости крови под влиянием дезагрегантов (курантил и др. ) лежит в основе их свойства повышать транспорт 02 в клетки сердца больных, страдающих от его ишемической болезни.
Объемная скорость кровотока по венечным артериям (Ус) - это прямая функция перфузионного давления миокарда (Рт) и обратная кс: Ус=РшЛ1с, где Рт - это градиент давлений, который вызывает ток крови в определенном участке системы венечных артерий. Кровь, протекающая по венечным артериям, возвращается в системный кровоток в основном через коронарный синус. Поэтому перфузионное давление миокарда для части сердца, которой отдает кислород кровь, попадающая в правое предсердие через коронарный синус, - это различие между диастолическим артериальным давлением и соответствующим давлением в правом предсердии. Венозная кровь, оттекающая от субэндокардиального слоя миокарда левого желудочка, возвращается в системный кровоток последовательно через тебезиевы вены и полость левого желудочка. Поэтому перфузионным давлением для миокарда субэндокардиального слоя левого желудочка следует считать градиент диастолического артериального давления и конечно-диастолического давления крови в полости левого желудочка.
Кровоток в правом желудочке непрерывен и не прекращается в диастолу. Кровоснабжение субэндокардиального слоя миокарда левого желудочка происходит только во время диастолического интервала сердечного цикла. Артериолы субэндокардиального слоя подвергаются почти полному сжатию во время систолы под воздействием роста давления крови в левом желудочке и вследствие особой выраженности укорочения миокардиоцитов данной части сердечной мышцы во время ее систолического сокращения. Лишь 15 % объема крови, поступающего по венечным артериям в левый желудочек за единицу времени, омывает субэндокардиальный слой миокарда левого желудочка во время систолы. В систолический интервал сердечного цикла кровь поступает преимущественно в эпикардиальный слой миокарда левого желудочка. В диастолический интервал вся кровь, поступающая по венечным артериям в левый желудочек, попадает в субэндокардиальный слой.
Результатом наибольшей среди всех сократительных элементов сердца интенсивности сокращения кардиомиоцитов субэндокардиального слоя левого желудочка выступают наибольшие потребность в кислороде и его потребление в данной части сердца. Поэтому большинство из микрососудов в субэндокардиальном слое предельно расширены вследствие максимальной в пределах сердца интенсивности аэробного метаболизма в кардиомиоци- тах этой локализации. Можно считать, что в субэндокардиальном слое почти нет резерва роста доставки кислорода с кровью кардиомиоцитам по микрососудам.
Высокая потребность в кислороде кардиомиоцитов субэндокардиального слоя левого желудочка, прерывистый характер его кровоснабжения, а также низкий резерв роста объемной скорости тока артериальной крови по микрососудам в данной части сердца - все это определяет особую подверженность субэндокардиального слоя левого желудочка инфаркту миокарда.
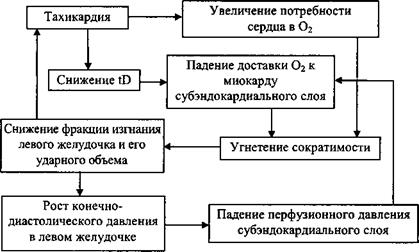
Общая длительность диастолических интервалов за минуту (Ю) - это обратная функция частоты сердечных сокращений. Рост частоты сердечных сокращений от 60 мин'1 до 100 минг1 вызывает снижение гВ от 34 с/мин до 27 с/мин и соответственно снижает кровоснабжение субэндокардиального слоя. Особенно неблагоприятная ситуация складывается тогда, когда снижение ударного объема левого желудочка как основное звено патогенеза тяжелой сердечной недостаточности недостаточности служит стимулом для предельно выраженной тахикардии (схема. 9. 1).
Сужение (стеноз) венечных артерий вследствие спазма или атеросклеротического поражения через рост сосудистого сопротивления вызывает снижение доставки кислорода кардиомиоцитам.
Фиксированный стеноз - это сужение просвета венечной артерии, которое некоторое время остается неизменным вследствие обтурации сосуда атеросклеротической бляшкой, ареактивности патологически измененной сосудистой стенки к сосудосуживающим влияниям и ригидности измененного атеросклерозом участка сосуда.
Динамический стеноз - транзиторное сужение венечной артерии как результат интенсификации сосудосуживающих регуляторных влияний. Грудную жабу вследствие динамического стеноза называют вазоспастической стенокардией (стенокардия Принцметала). Если динамический стеноз возникает в области атеросклеротической обтурации венечной артерии при сохраненной или повышенной реактивности ее стенки по отношению к сосудосуживающим влияниям, то развивается нестабильная стенокардия.
Различают локальный стеноз, захватывающий небольшой участок венечной артерии, равный по протяженности длиннику атеросклеротической бляшки обычного размера и более протяженный сегментарный стеноз. В соответствии с законом Пуазейля, сегментарный стеноз, в большей степени повышая сосудистое сопротивление, вызывает большее падение объемной скорости кровотока и доставки кислорода к клеткам сердца.
Снижение диаметра внутреннего поперечного сечения венечной артерии (просвета) фс) на 50 % снижает площадь просвета артерии на 75 %.
|
Схема 9. 1. Порочный круг патогенеза тяжелой сердечной недостаточности |
Стеноз такой степени уже проявляет себя стенокардией. Если De снижен на 75 %, то площадь просвета падает до 10 % от исходной величины. Такое сужение приводит к стенокардии покоя. Два структурно не связанных между собой сужения просвета венечной артерии атеросклеротического происхождения приводят к двум последовательным падениям динамического давления крови в просвете артерии, которое может представлять собой звено патогенеза циркуляторной гипоксии кардиомиоцитов.
Если атеросклеротическая обтурация венечной артерии развивается медленно, то снижение скорости объемного кровотока компенсирует возросший ток крови по коллатералям, соединяющим разные венечные артерии или разные сегменты одной артерии. Компенсаторная интенсификация коллатерального кровотока не предотвращает циркуляторной гипоксии миокарда вплоть до ишемии вследствие стеноза крайней степени, при которой площадь просвета артерии падает до 10 % от исходной.
Степень дисфункции сердца как насоса системы кровообращения, которую вызывает стеноз венечной артерии, связана с величиной той части сердца, в которой вследствие сужения венечной артерии развиваются циркуляторная гипоксия или ишемия. В этой связи в прогностическом отношении наиболее неблагоприятным следует признать стеноз левой главной венечной артерии, когда единичный локальный стеноз приводит к ишемии значительной части всего сердца. Стеноз ветвей левой главной венечной артерии приводит к гипоксии миокарда аналогичной по протяженности той, которую вызывает сужение левой главной венечной артерии. При этом кол- латераль от стенозированной артерии соединяет ее с полностью обтуриро- ванной ветвью левой главной венечной артерии (эквивалент стеноза левой главной венечной артерии).
У больных сахарным диабетом доставку кислорода кардиомиоцитам снижает диабетическая микроангиопатия, которая утолщает стенку капилляров, препятствуя массопереносу кислорода из их просвета в цитозоль клеток сердца.
Если строго в патофизиологическом смысле под ишемией понимают патологическое состояние и некробиотические изменения тканей, обусловленные полным прекращением их кровоснабжения, то термин «ишемия», используемый в клинической практике, означает неадекватное снабжение кардиомиоцитов кислородом вследствие падения к ним транспорта 02 с кровью.
Падение объемной скорости кровотока по венечной артерии как причина циркуляторной гипоксии кардиомиоцитов выступает инициирующим моментом ряда порочных кругов пато-танатогенеза. Поэтому одно восстановление объемной скорости кровотока по венечной артерии (вазодилятаторы, тромболитическая терапия) не может подвергнуть обратному развитию нарушения функций и гибель клеток сердца вследствие ишемии.
К механизмам гибели клеток сердца при тяжелой ишемии сердца относят:
♦ накопление продуктов обмена веществ, дальнейшая трансформация которых на путях метаболизма невозможна вследствие гипоэргоза;
♦ активация мембранных фосфолипаз;
♦ образование свободных радикалов кислорода;
♦ инфильтрация ишемизированного участка сердца активированными нейтрофилами;
|
|
|