|
Этапы функционирования нейтрофилов как клеточных эффекторов острого воспаления 2 страница
|
|
|
|
♦ гиперкатехоламинемия в крови, притекающей к кардиомиоцитам по венечным артериям;
♦ рост концентрации ионизированного кальция в цитоплазме кардиомиоцитов;
♦ гипоэргоз как следствие недостаточного гликолиза и причина нарушений ионного состава и отека клеток сердца.
Электрофизиологические свойства и сократительная способность кардиомиоцитов в основе своей имеют активное (происходящее с использованием свободной энергии) функционирование системы поддержания ионного равновесия между клетками сердца и средой их обитания. Уже через несколько секунд после возникновения ишемии кардиомиоцитов изменения клеточного метаболизма вызывают нарушения трансмембранного потенциала и способности клеток к сокращению.
Вследствие гипоэргоза (энергетического голодания) в клетках сердца компенсаторно активируется анаэробный гликолиз, который не может устранить недостатка свободной энергии. Гипоэргоз клеток сердца в силу ограниченности в них запасов аденозинтрифосфата (АТФ) и креатинфосфата развивается быстро. Данные экспериментов свидетельствуют, что процесс цитолиза клеток сердца становится необратимым, когда содержание в них АТФ падает до уровня меньшего, чем 10 % величины нормального содержания.
Сердце для биологического окисления может использовать все из доступных в организме источников свободной энергии. Натощак, когда уровень липолиза относительно высок, миокард в основном утилизирует свободные жирные кислоты. ' Если физическая нагрузка, военно-травматический шок, сепсис, другие патологические состояния и процессы приводят к лактатному ацидозу, то основным источником свободной энергии для кар- диомиоцитов становится молочная кислота. У больных, которым производят внутривенную инфузию раствора глюкозы и инсулина, биологическому окислению в сердце преимущественно подвергается глюкоза. В этой связи можно считать, что в силу широкого спектра веществ, циркулирующих с кровью, которые сердце может использовать в качестве энергетических субстратов, снижение содержания в плазме крови того или иного источника свободной энергии не ограничивает потребления свободной энергии миокардом.
|
|
|
Интенсивность и адекватность улавливания и утилизации кардиомио- цитами свободной энергии в основном зависит от соотношения между их потребностью в кислороде и доставкой к ним Ог
35 % массы сердечной мышцы составляют митохондрии. Как орган, в котором особенно высок уровень аэробного метаболизма, сердце обладает рядом особенностей:
1. Особо высокая активность в кардиомиоцитах энзимов биологического окисления - необходимое условие нормальной насосной функции сердца. Этот исключительный среди других органов организма уровень активности дыхательных ферментов возможен лишь в определенном диапазоне колебаний в цитозоле и митохондриях кардиомиоцитов напряжения кислорода. При патологическом снижении напряжения 02 уровень активности дыхательных ферментов резко падает, и возникает дисфункция сердца как насоса системы кровообращения, то есть развивается сердечная недостаточность.
2. Функция сердца зависит от определенного уровня аэробного гликолиза, поддержание которого невозможно без нормального отношения потребности сердца в кислороде к доставке ему 02. Патологический рост отношения быстро угнетает аэробный гликолиз. В результате возникает дефицит свободной энергии в кардиомиоцитах, обуславливающий падение сократимости и расстройства сердечного ритма.
Когда транспорт кислорода по венечным артериям полностью удовлетворяет потребность в нем сердца, то концентрации цитрата и аденозинтри- фосфата в цитозоле кардиомиоцитов достаточно велики для того, чтобы тормозить активность ключевого фермента анаэробного гликолиза фосфоф- руктокиназы. Падение напряжения кислорода в цитозоле кардиомиоцитов ниже определенного уровня ведет к снижению в нем содержания аденозйн- трифосфата и цитрата и растормаживает анаэробный гликолиз. При ишемии в строго патофизиологическом смысле, когда аккумуляция лактата и протонов вследствие прекращения кровотока тормозит в кардиомиоцитах анаэробный гликолиз, клетки сердца лишаются последнего источника свободной энергии. Кроме того, свою роль в торможении анаэробного гликолиза играет обусловленное гипоксией и прекращением кровотока накопление в кардиомиоцитах восстановленного никотинамидадениндинуклеотида.
|
|
|
Энергетическое голодание клетки и рост содержания протонов в ее цитозоле тормозят большинство из биохимических реакций на клеточных мембранах и в клетке, которые протекают при участии ферментов. Основным следствием тотального на клеточном уровне угнетения активности ферментов выступает нарушение ионного равновесия между клеткой и средой ее обитания. В частности, прекращается активный АТФ-зависимый транспорт ионов.
Вызванная энергетическим голоданием блокада активного выведения натрия из клетки и связанного с ним поступления в клетку калия приводит к росту содержания натриевого катиона в цитозоле клеток, испытывающих недостаток кислорода. Кроме того, рост содержания протонов в цитозоле клеток увеличивает АТФ-независимое выведение из клетки Н+ в обмен на поступление в нее катиона натрия. Это служит причиной еще большего увеличения содержания натрия в клетках. Рост содержания натрия ведет к поступлению в клетки воды из межклеточных пространств. Отек клеток обостряет их гипоксию, создавая чисто механическое препятствие периферическому кровообращению в зоне циркуляторной гипоксии.
Одновременно с ростом содержания натрия и развитием клеточного отека из клеток выходит калий. Предположительно выход калия обусловлен открытием в результате гипоэргоза АТФ-зависимого мембранного калиевого канала.
|
|
|
В соответствии с законом поддержания электронейтральности жидких сред организма выход калия из клеток задерживает в них протоны, что ускоряет развитие внутриклеточного ацидоза. Ацидоз развивается быстро, в течение первых 10 с ишемии, одновременно со снижением сократительной способности ишемизированного участка миокарда.
Увеличение содержания кальция в цитоплазме клеток сердца, испытывающих острый дефицит кислорода, - это результат снижения скорости связывания кальция саркоплазматическим ретикулумом вследствие гипоэргоза кардиомиоцитов. Накопление кальция служит инициирующим моментом трех звеньев патогенеза ишемии клеток сердца, одновременно выступающих частными механизмами цитолиза кардиомиоцитов:
♦ ишемическая контрактура сократительных кардиомиоцитов как результат постоянно высокой концентрации ионизированного кальция в цитоплазме, контрактура ведет к еще большему снижению кровоснабжения участка сердца, страдающего от циркуляторной гипоксии, и необратимости некробиотических изменений;
♦ увеличение содержания кальция в митохондриях, которое само по себе угнетает улавливание свободной энергии в виде АТФ при биологическом окислении;
♦ активация фосфолипаз, ведущая к деструкции клеточных мембран через накопление поверхностноактивных лизолецитинов.
Увеличение содержания кальция в цитоплазме ведет к захвату ионов кальция митохондриями, что увеличивает суммарный положительный заряд во внутримитохондриальном пространстве. Для уравновешивания роста положительного заряда в митохондриях в них происходит активный, связанный с потреблением свободной энергии в виде АТФ, процесс перемещения протонов из митохондрий в цитоплазму. Это еще в большей степени ограничивает величину свободной энергии, улавливаемой кардио- миоцитами в виде АТФ, так как часть АТФ утилизируется для выведения протонов из митохондрий.
Избыток кальция в цитоплазме ведет к сердечным аритмиям, снижающим ударный объем левого желудочка. Артериальная гипотензия как осложнение сердечной недостаточности, прогрессирующей вследствие аритмий, увеличивает гипоэргоз сердца и кардиомиоцитов, снижая перфузионное давление миокарда.
|
|
|
Повреждения и дисфункция кардиомиоцитов вследствие ишемии и последующего возобновления кровотока в ишемизированном участке сердца во многом связаны с действием на клетки сердца свободных радикалов кислорода.
Под свободным кислородным радикалом понимают молекулу, которая содержит непарный электрон на внешней орбите, составляющего ее атома кислорода. Это лежит в основе высокой способности такой молекулы вступать в реакции с другими соединениями, то есть проявлять высокую реак- тогенность. В кардиомиоцитах восстановление кислорода с образованием молекулы воды при биологическом окислении идет двумя путями:
♦ тетравалентная восстановительная реакция с участием митохондриальной цитохромоксидазы без образования каких-либо промежуточных соединений, в ходе которой 95 % кислорода входят в состав молекул образуемой воды;
♦ моновалентная реакция, в ходе которой образуются промежуточные соединения: супероксидные анионы, перекись водорода, гидроксильный радикал, обладающие непарными электронами на внешней орбите атомов кислорода.
Супероксидный анион относительно других свободных кислородных радикалов, образуемых при моновалентной реакции, обладает относительно низкой реактогенностью. В физиологических условиях в реакции дис- мутации он трансформируется в перекись водорода. Это более стойкое соединение с еще меньшей реактогенностью, которое способно диффундировать на значительное расстояние от места своего образования. Опасность роста содержания в клетках сердца перекиси водорода состоит в образовании из нее в реакциях Хабер-Вайса и Фентона гидроксильного радикала.
Гидроксильный радикал - соединение нестойкое, но он обладает крайне высокой реактогенностью и активно встраивается в боковые цепи ненасыщенных жирных кислот, приводя к перекисному окислению липидов. Выраженность цитотоксичности этих реакций во многом определяется доступностью в локусе их протекания ионов металлов с переходной валентностью, выступающих катализаторами образования высоко реактогенно- го гидроксильного иона.
Ишемия вызывает сдвиги клеточного обмена, способствующие образованию свободных кислородных радикалов из того молекулярного кислорода, который клетка содержит после развития ишемии.
В разные периоды ишемии и реперфузии источники образования свободных кислородных радикалов различны. Например, радикалы образуются в митохондриях, на других мембранных структурах клеток миокарда, эдотелио- и лейкоцитов. Во время ишемии идет восстановление элементов электронно-транспортной цепи митохондрий, что приводит к усиленной утечке электронов из дыхательной цепи, которые, реагируя с молекулярным кислородом, образуют супероксидные радикалы. Реперфузия восстанавливает биологическое окисление и улавливание свободной энергии в митохондриях, но интенсивность тока электронов по электронно-транспор- тной цепи при реперфузии невелика из-за недостатка аденозиндифосфата, что вновь служит причиной образования свободных кислородных радикалов. Вероятно, что в ранних стадиях ишемии увеличенному образованию свободных кислородных радикалов противостоит действие супероксиддис- мутазы (СОД). Активность супероксиддисмутазы выступает обратной функцией длительности ишемии. В результате низкой активности СОД после длительной ишемии митохондрии подвергаются все более и более сильному деструктивному действию свободных кислородных радикалов.
|
|
|
Эндотелиоциты капилляров содержат фермент ксантиндегидрогеназу. Ишемия ведет к трансформации энзима в оксидазную форму, катализатор превращения гипоксантина и ксантина в мочевую кислоту. При этом кислород выступает в роли акцептора электронов. Кислород, поступающий в ишемизированный участок сердца при реперфузии, восстанавливается данной ферментной системой с образованием свободных радикалов.
Активированные нейтрофилы генерируют свободные радикалы, действие которых на мембраны клеток служит одной из причин вторичной альтерации при воспалении, в том числе и сугубо патогенном, которое не имеет биологической цели. В результате вторичной альтерации, связанной с высвобождением свободных кислородных радикалов активированными полинуклеарами, растет зона ишемического повреждения миокарда. Неясно, является ли активация нейтрофилов следствием ишемии и реперфузии, или это результат воспалительной реакции на некробиотические изменения клеточных элементов сердца.
Образование свободных кислородных радикалов на мембранах кардио- миоцитов связано с каскадом реакций образования арахидоновой кислоты и аутокисления катехоламинов. Активация фосфолипаз служит причиной гысвобождения арахидоната и норадреналина. Аутоокисление катехоламинов, высвобождаемых ишемизированным миокардом, также служит источником свободных кислородных радикалов.
Итак, ишемия и реперфузия ведут к массивному образованию свободных кислородных радикалов в клетках сердца. Свободные кислородные радикалы вызывают перекисное окисление липидов, выступающего в качестве основной причины деструкции клеточных мембран. Предположительно, свободные кислородные радикалы также вызывают конформационные изменения мембранных протеинов и локализацию ряда белков-ионообмен- ников. Этим объясняют патологические изменения трансмембранного транспорта ионов, предшествующие необратимой деструкции мембраны.
При неугнетенных аэробных биологическом окислении и гликолизе, несмотря на непрерывное образование свободных кислородных радикалов, кардиомиоциты нормально функционируют, благодаря равновесию между системами, генерирующими оксиданты, и защитными антиоксидантными системами. В сердце антиоксидантные системы представлены ферментами супероксиддисмутазой (СОД), каталазой и глутатионпероксидазой, а также другими эндогенными антиоксидантами: витамином Е, аскорбиновой кислотой и цистеином. Основной антиоксидантной системой кардиомиоцитов выступает СОД. Этот фермент представляет собой катализатор дисмутации супероксидных анионов в перекись водорода и молекулярный кислород, ускоряя скорость этой реакции в 109 раз. Одна из форм СОД содержит медь и цинк и присутствует в цитоплазме, другая, содержащая марганец, находится в митохондриях.
В инактивации перекиси водорода как основного источника высокоре- актогенного и особо цитотоксичного гидроксильного радикала существенную роль играют ферментные системы каталазы и глутатионпероксидазы, содержание которой в кардиомиоцитах выше. При ишемии резко падает концентрация в клетках сердца восстановленной формы шутатиона (ВФГ). Одновременно гипоэргоз угнетает активное выведение из клетки окисленной формы глутатиона (ОФГ). В результате в кардиомиоцитах почти блокируется превращение ВФГ в ОФГ, необходимое для активации глутатионпероксидазы. Поскольку глутатионпероксидаза удаляет из клеток перекись водорода, ишемия и гипоэргоз через резкое снижение активности глутатионпероксидазы ведут к аккумуляции в цитозоле клеток сердца Н20,.
Витамин Е как антиоксидант действует в синергизме с аскорбиновой кислотой, захватывая свободные кислородные радикалы. В силу своей ли- пофильной природы витамин Е выступает в качестве внутримембранного антиоксиданта, тогда как витамин С, основной элемент водорастворимой системы электронного транспорта, осуществляет свое действие в цитоплазме или во внеклеточной жидкости.
Ишемия угнетает защитные антиоксидантные внутриклеточные системы. В основном эти патологические сдвиги затрагивают, по-видимому, митохондриальную супероксиддисмутазу, активность которой вследствие полного прекращения доставки к клеткам кислорода с кровью падает на 50 %.
После угнетения гипоксическим гипоэргозом антиоксидантных систем клетки восстановление доставки к ней молекулярного кислорода предположительно повышает образование свободных кислородных радикалов до уровня, превышающего нейтрализующую способность митохондриальной СОД (окислительный стресс). Восстановление кровотока (реперфузия) после кратковременной ишемии (30-60 мин) не вызывает окислительный стресс в силу относительной интактности антиоксидантных систем. Реперфузия после длительной ишемии, когда защитные механизмы более ослаблены, через окислительный стресс вызывает некробиотические изменения кардиомиоцитов. Снижение активности СОД вследствие ишемии и реперфузии специфично для митохондриальной СОД.
Падение активности митохондриальной СОД нарушает функцию митохондрий и в еще большей степени блокирует улавливание клеткой свободной энергии. Предположительно вследствие угнетения антиоксидант- ной системы митохондриальной СОД резко растет активность второй по значимости антиоксидантной системы кардиомиоцитов, системы глута- тионпероксидазы.
Быстрое восстановление кровообращения в ишемизированном участке сердца под влиянием тромболитической терапии - это наиболее эффективный способ восстановления функций, испытавших гипоксию и гипоэргоз кардиомиоцитов. Однако запоздалая реперфузия, восстанавливающая доставку кардиомиоцитам с угнетенными антиоксидантными системами кислорода как субстрата образования свободных кислородных радикалов, усиливает некробиотические изменения клеток сердца и ускоряет их цитолиз. Поэтому в настоящее время ведется интенсивный поиск и исследование средств, увеличивающих антиоксидантную способность клеток сердца.
Ишемия вызывает цитолиз, активируя разрушающие мебраны кардиомиоцитов фосфолипазы. Эти ферменты катализируют трансформацию нормальных липидов клеточных мембран в поверхностноактивные соединения, которые разрушают мембраны. Так, гипоксия и гипоэргоз активируют фосфолипазу А2, при воздействии которой на лецитин мембран образуется лизолецитин. Лизолецитин, вступая в соединение с молекулой любой несвязанной внутриклеточной кислоты (линолевой и др. ), образует высоко поверхностноактивные лизофосфолипидные мицеллы, что служит причиной деструкции мембран.
Ишемия сердечной мышцы, особенно проявляющая себя стенокардией, ведет к усилению адренергической нейрогуморальной стимуляции сердца. В результате происходит избыточная аккумуляция в кардиомиоцитах циклического аденозинмонофосфата. Это служит причиной устойчивого и патогенного возрастания содержания в цитозоле ионизированного кальция, дисфункций и цитолиза клеток сердца.
Гипоксический гипоэргоз ведет к аккумуляции в цитозоле клеток сердца цитотоксичных продуктов метаболизма. К ним относят поверхностноактивные липиды, образующиеся из неокисленных экзогенных жирных кислот.
Ишемия, тяжелая циркуляторная гипоксия и гипоксический гипоэргоз сердца вызывают цитолиз его клеток и через патогенные межклеточные взаимодействия, составляющие порочный круг патогенеза при ишемии (схема 9. 2).
Активированные нейтрофилы в зоне ишемического повреждения сердца представляют собой клеточный эффектор острого воспаления, во многом лишенного биологической цели, которое через высвобождение поли- морфонуклеарами свободных кислородных радикалов и экзоцитоз из нейтрофилов протеолитических ферментов увеличивает массу кардиомиоцитов, подвергшихся некробиотическим изменениям. Каскад реакций свертывания крови и связанная с ним активация системы комплемента по альтернативному пути, аккумуляция в ишемизированном участке такого флогогена как лейкотриен В4 служат индукторами воспаления в части сердца, пораженной гипоксией и гипоэргозом.
Роль патогенных межклеточных взаимодействий в распространении зоны ишемических повреждений клеток, которые в очаге ишемии и воспаления во многом осуществляются через высвобождение клетками цитокинов, под-
|
Схема 9. 2. Порочный круг межклеточных взаимодействий при ишемии |
черкивает следующее определение ишемии миокарда: миокардиальная ишемия - это гипоксия миокарда, которую характеризуют
♦ интенсивное высвобождение соответствующими клетками в очаге ишемического повреждения фактора некроза опухолей;
♦ усиленное образование в нем свободных кислородных радикалов;
♦ потеря микрососудами из системы венечных артерий в зоне ишемического повреждения способности к расширению в ответ на сосудорасширяющие паракринные влияния со стороны эндотелиоцитов;
♦ некробиотические изменения кардиомиоцитов.
Известно, что рекомбинантный фактор некроза опухолей, не обладающий биологической активностью своего естественного аналога, но тормозящий экспрессию его гена, сохраняет реактивность гладкомышечных элементов сосудистой стенки ветвей венечных артерий по отношению к вазодилатирующим паракринным сигналам их эндотелиоцитов и снижает выраженность некробиотических изменений клеток сердца, обычно вызываемых эндогенным фактором некроза опухолей.
Усиленная адгезия полиморфонуклеаров к эндотелиоцитам в зоне ишемии представляет собой результат активации нейтрофилов и (или) эндотелиоцитов. In vitro гипоксия эндотелиоцитов с последующим восстановлением доставки к ним кислорода приводит к росту прилипания полиморфонуклеаров к эндотелиальным клеткам, который в основном связан с функционированием таких адгезивных молекул как Р-селектин, Е-селектин, а также межклеточная адгезивная молекула-1. Свою роль в адгезии нейтрофилов к эндотелию играют эндотелиоцитарный интерлейкин-1, фактор активации тромбоцитов, а также высвобождаемые эндотелиоцитами при ишемии и реперфузии свободные кислородные радикалы, тромбоксан В2 и сниженное образование оксида азота. Значение адгезивных молекул в развитии воспаления в ответ на ишемию подчеркивает торможение воспаления антителами, специфичными по отношению к ним. В эксперименте было показано, что такие антитела снижают выраженность некробиотических изменений тканей, связанных с ишемией и реперфузией.
Главную цель терапии ишемической болезни сердца, то есть его циркуляторной гипоксии, можно определить следующим образом:
Оптимальное снижение отношения между потребностью сердца в кислороде и доставкой к его клеткам 02, которое повышает способность сердца реагировать усилением насосной функции в ответ на рост потребления кислорода всем организмом. Иными словами, необходимо так снизить потребность кардиомиоцитов в кислороде и повысить транспорт 02 в их цитозоль, чтобы сердце отчасти или полностью восстановило способность повышать выброс крови в аорту и легочную артерию для удовлетворения возросшей потребности органов и тканей в кислороде, энергопластических субстратах и агентах гуморальной регуляции.
Данная цель терапии хронической циркуляторной гипоксии миокарда, обусловленной атеросклерозом, недостижима без строгого следования общим принципам лечения стенокардии, которые сводятся к устранению факторов риска атеросклероза. Так, важно прекратить курение и через применение системы общеоздоровительных мероприятий и антигиперлипопро- теинемических средств произвести коррекцию гиперхолестеринемии; существует возможность обратного развития атеросклеротического поражения сосудов, если содержание холестерина в плазме крови падает до уровня 1, 5—1, 8 г/л.
Исторически первыми средствами терапии стенокардии были нитраты, которые остаются одним из основных средств лечения ишемической болезни сердца. Одной из положительных сторон действия нитратов следует считать снижение ими конечно-диастолического давления в левом желудочке через снижение общего венозного возврата к сердцу. Действуя таким образом, нитраты повышают перфузионное давление субэндокардиальнош слоя миокарда левого желудочка (схема 9. 3).
Назначения нитратов и других сосудорасширяющих средств избегают при стенокардии, обусловленной тяжелым аортальным стенозом. Гипоэр- гоз клеток сердца, который проявляет себя грудной жабой, у больных с аортальным стенозом обусловлен не атеросклеротическим поражением венечных артерий, а прежде всего кардиомиопатией, вторичной по отношению к концентрической гипертрофии стенок левого желудочка в стадии декомпенсации. В этой стадии развитие сети капилляров миокарда и его нервных элементов отстает от роста массы кардиомиоцитов. У больных с аортальным стенозом в его терминальной стадии нитраты могут через снижение преднагрузки сердца опасно уменьшить конечно-диастолический объем левого желудочка. Это резко ограничивает его ударный объем, и без того уже сниженный вследствие сердечного порока. Поэтому назначение нитратов больным со стенокардией вследствие аортального стеноза может привести к трудно купируемой артериальной гипотензии.
Нитраты и вазодилятаторы не применяют при гипертрофической кар- диомиопатии, так как снижение конечно-диастолического объема левого
|
Схема 9. 3. Положительные стороны фармакодинамики нитратов при лечении ишемической болезни сердца |
желудочка при обструкции его выносящего тракта также может привести к опасному снижению АД. При кардиогенном шоке дилатация вен и резистивных сосудов вследствие эффекта нитратов на сосудистую стенку может привести к необратимой артериальной гипотензии.
Бета-блокаторы - это неоднородная группа препаратов, представителей которой классифицируют в зависимости от избирательности действия на бета-один- и бета-два-адренорецепторы. Через снижение интенсивности стимуляции кардиальных бета-адренорецепторов бета-блокаторы снижают частоту сердечных сокращений и в меньшей степени уменьшают силу сокращений саркомеров миокарда. Все это может привести к снижению потребности сердца в свободной энергии, снизить остроту гипоэргоза кардио- миоцитов и устранить стенокардию.
В малых дозах бета-один-селективные средства (метопролол и атено- лол) вызывают бронхоспазм реже, чем бета-блокаторы, лишенные такой избирательности. Кроме того, в небольших дозах, бета-один-селективные средства в меньшей степени способствуют прогрессированию атеросклероза периферических артерий.
|
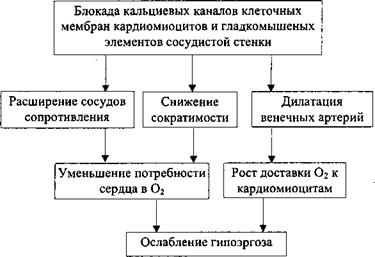
Схема 9. 4. Позитивные стороны фармакодинамики антагонистов кальция |
Неизбирательные бета-блокаторы, блокируя возбуждение сосудистых бета-два-адренорецепторов на периферии, через спазм периферических артерий небольшого диаметра и связанную с ним модуляцию высвобождения эндотелиоцитарных цитокинов, могут ускорить развитие атеросклероза.
Необходимо тщательно «титровать» дозу бета-блокатора у каждого больного, прекращая ее увеличивать, когда частота сердечных сокращений снизится до 55-60 мин-1 в покое и до 90-100 мин1 при нагрузке. Дальнейшее увеличение дозы, еще более усиливая отрицательный эффект блокады бета- один-адренорецепторов на частоту генерации импульсов возбуждения водителем ритма, проводимость и сократимость кардиомиоцитов, может привести к артериальной гипотензии. В этой связи вполне понятно выделение таких противопоказаний к назначению бета-блокаторов как тяжелая сердечная недостаточность и выраженная брадикардия в покое. Следует заметить, что при использовании бета-адреноблокаторов, обладающих внутренней симпатомиметической активностью (ацебутолол), не следует ориентироваться на частоту сердечных сокращений в условиях покоя как на критерий силы действия препаратов данного класса.
Кроме того, противопоказаниями к назначению бета-один-адрено- блокаторов служат обструктивные расстройства внешнего дыхания (в том числе и в анамнезе) и тяжелый облитерирующий атеросклероз периферических артерий.
Антагонисты кальция - неоднородная группа лекарственных средств, в различной степени обладающих рядом позитивных эффектов на звенья патогенеза ишемической болезни сердца (схема 9. 4). В основе такого побочного действия антагонистов кальция как головокружение лежит снижение кровотока через соответствующие центры головного мозга, связанное с уменьшением ударного объема левого желудочка при падении общего периферического сосудистого сопротивления под влиянием антагонистов кальция. При этом в результате церебральной ауторегуляции объемной скорости кровотока, на которую не влияют антагонисты кальция, общее сосудистое сопротивление на уровне головного мозга не подвергается значительным изменениям. Все это влечет за собой перераспределение минутного объема кровообращения с падением объемной скорости кровотока в головном мозге.
Опасным осложнением терапии с использованием антагонистов кальция выступает артериальная гипотензия, обусловленная снижением сократимости сердца и общего периферического сосудистого сопротивления. Периферические отеки как побочный эффект препаратов данной группы выступают следствием падения линейной скорости кровотока по капиллярам и возрастанием в них гидростатического давления вследствие снижения общего периферического сосудистого сопротивления и уменьшения силы сердечных сокращений.
Антагонисты кальция, которые служат средством выбора при лечении больных с ишемической болезнью сердца и непереносимостью нитратов и бета-блокаторов, как мощные коронарные вазодилятаторы особенно эффективны при стенокардии Принцметала, основное звено патогенеза которой - спазм венечных артерий.
Глава 10 ГОЛОДАНИЕ
Голодание - патологическое состояние, которое на определенной стадии развития характеризуют дисфункции всех функциональных систем, а также дефицит энергии и массы во всех органах эффекторах функций и клеточных элементах организма. Голодание вызывает низкая относительно потребностей клеток доставка к ним нутриентов или устойчивый (патологический) сдвиг метаболизма в сторону катаболических процессов.
Нутриенты - это вещества, которые представляют собой потенциальные источники свободной энергии, улавливаемой при биологическом окислении, или субстраты для анаболических процессов. Нутриенты поступают во внутреннюю среду организма после переработки пищи в ходе полостного, мембранного пищеварения и всасывания продуктов переработки из просвета кишечника или в результате расщепления с высвобождением нутриентов соединений, в виде которых организм аккумулирует источники энергии и пластический материал (гликоген, триглицериды жировой ткани и др. ).
|
|
|