 |
Сердечные аритмии как причины падения насосной функции сердца 4 страница
|
|
|
|
Добутамин - это синтетический катехоламин, преимущественно оказывающий бета-один-адреномиметическое действие и слабые бета-два- и альфа-один-адреномиметические эффекты. Тем не менее, слабые бета- два- и альфа-один-адреномиметические эффекты добутамина представляют собой «сильную» сторону его фармакодинамики, так как на периферии приводят через преобладание вазодилятации вследствие стимуляции бета-два-адренорецепторов над вазоконстрикцией вследствие возбуждения альфа-один-адренорецепторов к умеренному снижению сосудистого сопротивления. Умеренное снижение ОПСС под влиянием добутамина вкупе с увеличением объема крови, который левый желудочек за минуту выбрасывает в аорту, ведут к росту системного транспорта кислорода. Если добутамин использовать одновременно с бета-адренолитиками, то он начинает выступать преимущественно в роли альфа-один-адрено- миметика и опасно повышает ОПСС. Непрерывная инфузия добутамина особенно эффективна для повышения МОК и устранения расстройств периферического кровообращения, если ее сочетать с непрерывным внутривенным вливанием допамина в дозах меньших, чем 5 мкг кг ' мин'1, при использовании которых эффект допамина в основном сводится к расширению сосудов сопротивления. При этом, осуществляя постоянный мониторинг МОК, артерио-венозного различия по кислороду и потребления кислорода организмом, дозу добутамина титруют в диапазоне от 2, 5 до 40 мкг-кг'-мин'1 до достижения оптимального уровня показателей системного транспорта кислорода.
Допексамин - это бета-два-адреномиметик, который может возбуждать допаминергические рецепторы. Препарат обладает свойствами слабого агониста к бета-один-адренорецепторам и тормозит захват норадре- налина нервными окончаниями, что и лежит в основе его положительного инотропного действия. Оказывая положительное инотропное действие, данное лекарственное средство через стимуляцию бета-два-адренорецеп- торов и домапинергических рецепторов расширяет сосуды сопротивления и увеличивает объемную скорость кровотока во внутренних органах. Резкое увеличение частоты сердечных сокращений как основной детерминанты потребности сердца в кислороде, которое вызывает допексамин, ограничивает его использование. Поэтому допексамин используют в течение недолгого времени для устранения острой сердечной недостаточности у кардиохирургических больных, инфузируя раствор препарата через внутривенный катетер большого диаметра. Непрерывную инфузию до- пексамина в 5 % растворе глюкозы начинают в дозе 0, 5 мкг-кг '-мин'1. Если МОК после начала непрерывной инфузии допексамина не растет, то дозу увеличивают до 1 мкг-кг'-мин'1. Когда такая доза не приносит желаемого эффекта, то через каждые 15 мин ее увеличивают на 1 мкг-кг'-мин1 до максимального уровня в 6 мкг-кг'-мин'1.
|
|
|
Длительное и непрерывное возбуждение бета-один-адреномимети- ками соответствующих рецепторов сердца ведет к а) снижению содержания в сердце бета-один-адренорецепторов и б) изменениям структуры бе- та-один-адренорецепторов, которое снижает их чувствительность. Этот эффект достигает своего максимума уже за 48 ч непрерывной инфузии допамина, добутамина и других препаратов данной группы. В такой ситуации прибегают к ингибиторам фосфодиэстеразы, чей положительный инотропный эффект на сердце в основе своей имеет угнетение фосфо- диэстеразных ферментов кардиомиоцитов, превращающих циклический аденозинмонофосфат в метаболит, не обладающий биологическим действием и свойствами вторичного мессенджера. Внутривенное введение первого из препаратов данной группы милринона начинают с медленной инфузии 50 мкг/кг массы тела препарата в течение 10 мин, вслед за которой следует непрерывная инфузия со скоростью 375-750 мг-кг ! -мин1 в течение 48-72 ч. Максимальная скорость внутривенного введения другого из препаратов данной группы эноксимона составляет 12, 5 мг/мин. Вначале эноксимон медленно вливают внутривенно в дозе 0, 5-1 мг/кг. Затем через каждые 30 мин внутривенно вводят по 0, 5 мг/кг до положительного эффекта или до достижения уровня суммарной дозы эноксимона, составляющей 3 мг/кг.
|
|
|
Ингибиторы фосфодиэстеразы, резко увеличивая содержание в клетках сердца ионизированного кальция, предположительно могут вызывать контрактуру саркомеров миокарда, резко угнетающую систолический и диастолический компоненты насосной функции желудочков сердца. Это, как мы полагаем, может быть одним из механизмов развития такого побочного эффекта как стойкая артериальная гипотензия.
Клинико-патофизиологическими показаниями к применению при кар- диогенном шоке бета-один-адреномиметиков и вазопрессоров служат рост конечно-диастолического давления левого желудочка (давления заклинивания легочной артерии) выше 18 мм рт. ст., падение сердечного индекса до уровня значений меньших, чем 2, 5 л-мин''-м, и систолическое АД ниже, чем 100 мм рт. ст., которые свидетельствуют о падении насосной функции левого желудочка, выступающей причиной артериальной гипотензии, несмотря на компенсаторный рост ОПСС. При таком крайне выраженном нарушении сократительной функции левого желудочка использование лекарств с положительным инотропным действием и вазопрессоров часто служит лишь средством предотвращения терминального состояния вследствие артериальной гипотензии и может придать угнетению сократимости необратимый характер. И те и другие средства повышают потребность сердца в кислороде, то есть на фоне предшествующего значительного дефицита свободной энергии в кардиомиоцитах резко усиливают их гипоэргоз.
КЛИНИКО-ПАТОФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
ОСЛОЖНЕНИЙ И ПЕРИОДА РЕАБИЛИТАЦИИ
ИНФАРКТА МИОКАРДА
Циркуляторная гипоксия кардиомиоцитов вследствие атеросклеротического поражения венечных артерий, инфаркт миокарда, вызывающий цитолиз и гибернацию клеток сердца как причины снижения его сократимости, могут приводить к недостаточности митрального клапана (митральной регургитации).
|
|
|
Митральная регургитация вследствие ишемической болезни сердца часто имеет преходящий характер. Обычно недостаточность митрального клапана, вторичная по отношению к циркуляторной гипоксии миокарда, возникает у больных, страдающих от застойной сердечной недостаточности вследствие ишемической болезни сердца. У других пациентов митральная регургитация возникает в результате обострения гипоксии сердца и подвергается обратному развитию по мере восстановления доставки кислорода клеткам сердца. Причинами недостаточности митрального клапана вследствие ишемической болезни сердца являются:
♦ снижение силы сокращений сосочковых мышц из-за недостаточной доставки к ним кислорода;
♦ расширение кольца митрального клапана, вторичное по отношению к дилатации полости левого желудочка при застойной сердечной недостаточности;
♦ разрыв некробиотически измененных сосочковых мышц.
В две сосочковые мышцы левого желудочка кровь поступает по конечным ветвям передней и задней венечных артерий. Наиболее удаленные от стенки желудочка (свободные, дистальные) участки сосочковых мышц постоянно испытывают прямое воздействие внутрижелудочкового давления. Недостаточный коллатеральный кровоток в обход обтуриро- ванного участка конечной ветви венечной артерии, кровоснабжающей дистальный участок сосочковой мышцы, постоянное прямое воздействие на свободный сегмент мышцы высокого давления крови в левой сердечной камере у больных с застойной сердечной недостаточностью обуславливают особую предрасположенность сосочковых мышц к некробиотиче- ским изменениям в результате циркуляторной гипоксии и ишемии.
Синхронность сокращения сосочковых мышц и рабочего миокарда левого желудочка представляет собой необходимое условие нормального функционирования митрального клапана, то есть плотного смыкания его створок в течение всей систолы. Недостаточная сила сокращений сосочковых мышц, удерживающих створки клапана в положении плотного смыкания, служит причиной пролабирования створок клапана в левое предсердие в конце систолы. Это проявляется патологическим сердечным шумом, выслушиваемым в конце систолы.
|
|
|
Дилатация левого желудочка у больных с сердечной недостаточностью смещает сосочковые мышцы вниз и в латеральном направлении от митрального клапана. В результате смещения систолическое сокращение сосочковых мышц удерживает створки клапана во время систолы в полости левого желудочка, препятствуя их смыканию и вызывая митральную регургитацию. О недостаточности митрального клапана, которая обусловлена застойной сердечной недостаточностью, свидетельствует дующий систолический шум, занимающий всю фазу изгнания сердечного цикла. Если действие сердечных гликозидов уменьшает дилатацию левого желудочка, то митральная регургитация такого генеза исчезает.
Расширение левого желудочка любого происхождения, в том числе и не связанное с ишемической болезнью сердца, на определенной стадии развития приводит к митральной регургитации. Если ишемическую болезнь сердца осложняет застойная сердечная недостаточность, то причинами митральной регургитации у таких больных могут быть как гипоксия сосочковых мышц, так и дилатация полости левого желудочка.
Вторичную легочную венозную гипертензию в результате связанного с инфарктом миокарда некроза сосочковых мышц левого желудочка у части больных можно устранить осторожным внутривенным введением вазодилятаторов (нитроглицерин, нитропруссид натрия), которые через снижение постнагрузки сердца увеличивают фракцию изгнания левого желудочка. Бета-один-адреномиметики, повышая силу сокращений миокарда левого желудочка, также увеличивают объем крови, который он за единицу времени забирает из системы легочной артерии и выбрасывает в аорту. Рост этого объема ведет к устранению кардиогенного отека легких.
Из других осложнений инфаркта миокарда следует выделить:
♦ разрыв межжелудочковой перегородки;
♦ разрыв свободной стенки левого желудочка;
♦ аневризму левого желудочка.
Разрыв межжелудочковой перегородки проявляет себя характерным систолическим шумом, генерируемым турбулентным движением крови через дефект перегородки из левого желудочка в правый во время систолы. Максимум звучности шума выявляют при аускультации у левого края грудины над ее нижней частью (проекция приобретенного дефекта межжелудочковой перегородки). Шунтирование крови слева направо в результате разрыва перегородки приводит к росту насыщения кислородом гемоглобина крови в правом желудочке. Клинико-патофизиологическим признаком разрыва межжелудочковой перегородки может выступать превалирование насыщения кислородом гемоглобина крови в правом желудочке над соответствующим показателем газотранспортной функции крови в правом предсердии на 5 % и более.
|
|
|
Транзиторного возрастания минутного объема кровообращения при кардиогенном шоке вследствие постинфарктного разрыва межжелудочковой перегородки можно достигнуть, снижая преднагрузку левого желудочка вазодилятаторами (нитроглицерин, нитропруссид натрия) и увеличивая выброс крови в аорту. В большинстве случаев лишь интрааорталь- ная контрпульсация позволяет поддерживать минимально достаточное артериальное давление в период до полной хирургической коррекции острого приобретенного порока.
Разрыв стенки левого желудочка как осложнение инфаркта миокарда обычно возникает в течение недели после его развития и в большинстве случаев приводит к тампонаде сердца. Это осложнение чаще возникает у больных с артериальной гипертензией, женщин и у пациентов, постоянно принимающих нестероидные противовоспалительные средства. Лишь пе- рикардиоцентез и неотложная интрааортальная контрпульсация позволяют выиграть время до начала хирургического вмешательства.
Клинико-патофизиологическими признаками инфаркта миокарда правого желудочка выступают падение минутного объема кровообращения до уровня меньшего, чем 2, 5 л-мин’^м'2 при нормальном или несколько сниженном конечно-диастолическом давлении левого желудочка и диастолическое давление крови в правом предсердии выше 10 мм рт. ст. Рост давления крови в правом предсердии во время диастолы - это следствие его патологически высокой постнагрузки, которую обуславливает возрастание конечно-систолического объема крови в правом желудочке в результате недостаточности его насосной функции, связанной с инфарктом миокарда.
Клинические признаки инфаркта миокарда правого желудочка представляют собой проявления системной венозной гипертензии как следствия правожелудочковой недостаточности:
♦ заметная (усиленная) пульсация яремных вен;
♦ симптом Куссмауля, то есть набухание яремных вен на вдохе;
♦ выявление при аускультации над правыми отделами сердца третьего и четвертого тонов.
Появление симптома Куссмауля - это результат переполнения кровью емкостных сосудов в фазу вдоха, когда присасывающее действие максимально субатмосферного давления в плевральной полости неадекватно низкой насосной функции правого желудочка. Угнетение насосной функции правого желудочка как следствие инфаркта его миокарда резко снижает объем крови, поступающий за единицу времени в легочную артерию. В результате гидростатическое давление в легочных капиллярах чаще остается на нормальном уровне или падает, чем растет, как при левожелудочковой недостаточности.
Если инфаркт миокарда правого желудочка осложняет артериальная гипотензия при систолическом артериальном давлении ниже, чем 90 мм рт. ст., то цель патогенетически ориентированной коррекции снижения АД - это увеличение минутного объема кровообращения через увеличение преднагрузки левого желудочка. Роста преднагрузки левого желудочка достигают одновременными внутривенным вливанием плазмозамещающих растворов (увеличение общего венозного возврата к сердцу) и непрерывной инфузией в вену бета-один-адреномиметиков, направленной на усиление насосной функции правого желудочка. При этом давление заклинивания в легочной артерии не должно быть выше 15-18 мм рт. ст.
Больные, выжившие в остром периоде после инфаркта миокарда, подвержены развитию застойной сердечной недостаточности, прогрессированию ишемической болезни сердца и циркуляторной гипоксии миокарда, его повторному инфаркту, сердечным аритмиям, в том числе и как причинам внезапной сердечной смерти. Вероятность внезапной сердечной смерти, связанной с инфарктом миокарда, наиболее высока в период первых шести месяцев после критического обострения циркуляторной гипоксии миокарда, приведшей к опасному падению насосной функции сердца (инфаркту миокарда). Преклонный возраст больных выступает фактором риска внезапной смерти, который не зависит от проводимых лечебно-профилактических и реабилитационных мероприятий. Наиболее подверженный благоприятным изменениям под влияниям лечебно-профилактических воздействий фактор риска внезапной сердечной смерти после инфаркта- это низкая насосная функция левого желудочка, о которой судят, определяя его фракцию изгнания или конечно-систолический объем. К маркерам высокого риска внезапной сердечной смерти в период реабилитации после инфаркта относят:
♦ грудную жабу в условиях покоя;
♦ циркуляторную гипоксию миокарда при дозированной физической нагрузке, которую выявляют специальными исследованиями и при отсутствии стенокардии;
♦ усиление обтурации венечных артерий атеросклеротического генеза;
♦ сердечные аритмии при эктопических водителях ритма, локализованных в желудочках;
♦ сниженная вариабельность временных интервалов 11-11 на электрокардиограмме как свидетельство нарушений регуляции сердечной деятельности автономной нервной системой;
♦ курение;
♦ гиперхолестеринемия;
♦ сахарный диабет.
Следует заметить, что, несмотря на высокую информативность радио- изотопных методов исследования ишемических повреждений сердца, если они не выявляют признаков дисфункции и цитолиза кардиомиоцитов при клинических признаках циркуляторной гипоксии миокарда и ее электрокардиографическом эквиваленте, то у больных в период реабилитации после инфаркта миокарда риск внезапной сердечной смерти все равно считают высоким.
Первые три из маркеров высокого риска внезапной сердечной смерти, связанной с инфарктом миокарда, представляют собой причины и следствия усиления циркуляторной гипоксии кардиомиоцитов, обусловленной атеросклеротическим поражением венечных артерий.
Четвертый маркер свидетельствует о тенденции сердца как органа- эффектора функциональных систем к дезинтеграции вследствие ишемических повреждений клеточных элементов сердца, участвующих в регуляции сердечной деятельности на органном уровне, в частности проводящих кардиомиоцитов.
Выявление пятого маркера говорит о высвобождении сердца из-под системных регуляторных влияний как предпосылке внезапной сердечной смерти вследствие атеросклероза и ишемии.
Последние три маркера - это известные факторы риска атеросклероза и инфаркта миокарда.
Падение насосной функции левого желудочка как первичное звено патогенеза синдрома малого сердечного выброса в остром периоде инфаркта миокарда в дальнейшем естественно превращается в фактор риска внезапной сердечной смерти в период реабилитации. Поэтому, наиболее значимые из маркеров риска внезапной сердечной смерти в течение шести месяцев после инфаркта миокарда - это клинические признаки низкой насосной функции левого желудочка:
♦ влажные хрипы над верхними и средними отделами легких как симптом легочной венозной гипертензии вторичной по отношению к падению систолического и диастолического компонентов насосной функции левого желудочка во время нахождения больного в отделении кардиологической интенсивной терапии;
♦ падение фракции изгнания левого желудочка в этот период до уровня меньшего, чем 40 %.
Глава 21
ПАТОГЕНЕЗ НАИБОЛЕЕ ЧАСТЫХ ВИДОВ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Любой длительный подъем артериального давления выше верхнего предела нормальных колебаний (табл. 21. 1) (артериальная гипертензия) может быть причиной заболеваний и патологических состояний сердца и сосудов. Известно, что вероятность развития ишемической болезни сердца, скрытых или явных сердечной и почечной недостаточности, а также нарушений мозгового кровообращения у взрослых людей с диастолическим артериальным давлением (АД) выше 90 мм рт. ст. в два раза выше, чем при диастолическом АД ниже 80 мм рт. ст.
Артериальная гипертензия - это патологическое состояние организма взрослых, обусловленное длительным подъемом систолического АД выше уровня в 140 мм рт. ст. и диастолического АД выше 90 мм рт. ст.
Если диастолическое АД ниже 90 мм рт. ст., а систолическое АД выше 160 мм рт. ст., то такую артериальную гипертензию определяют как изолированную систолическую артериальную гипертензию.
Долгое время рост общего периферического сосудистого сопротивления (ОПСС) считали ведущим звеном патогенеза первичной артериальной гипертензии (эссенциальной гипертензии, гипертонической болезни) у подавляющего большинства больных. В этой связи подъем диастолического АД, находящегося в прямой связи с ОПСС, признавали более неблагоприятным, чем рост систолического артериального давления. Поэтому степень тяжести артериальной гипертензии оценивали, ориентируясь на уровень диастолического артериального давления (табл. 21. 2).
В последние десятилетия была выявлена достоверная положительная связь высокого уровня систолического АД с риском осложнений артериальной гипертензии и связанных с нею заболеваний. Изолированная систолическая артериальная гипертензия у больных старше 65 лет особенно часто приводит к опасным осложнениям и болезням, причем в настоящее время нет эффективного способа ее коррекции. Поэтому тяжесть артериальной гипертензии определяют в соответствии с данными исследования как систолического, так и диастолического АД (табл. 21. 3).
При артериальной гипертензии в стадии предболезни фармакотерапию не применяют, стремясь устранить артериальную гипертензию рациональным усилением физической активности, диетой, психотерапией и полноценным отдыхом. Большинство клиницистов-исследователей сходятся во мнении, что фармакокоррекцию артериальной гипертензии следует начинать при устойчивом подъеме диастолического АД выше 95 мм рт. ст.
| Возраст | Систолическое АД, мм рт. ст. | Диастолическое АД, мм рт. СТУ |
| 3-5 лет | ||
| 6-9 лет | ||
| 10-12 лет | ||
| 13-15 лет | ||
| Взрослые |
| Таблица 21. 1 |
| Степень тяжести | Определение степени тяжести | Диастолическое АД, мм рт. ст. |
| I | Незначительная, «мягкая» | 90-104 |
| Умеренная | 105-119 | |
| III | Тяжелая | выше 120 |
| Таблица 21. 2 |
| Степень тяжести | Систолическое АД, мм рт. ст. | Диастолическое АД, мм рт. ст. |
| Артериальная гипертензия в стадии «предболезни» | 130-139 | 85-95 |
| Незначительная | 140-159 | 90-99 |
| Умеренная | 160-179 | 100-109 |
| Тяжелая | 180-209 | 110-119 |
| Крайне тяжелая | Не менее 210 | Не менее120 |
| Таблица 21. 3 |
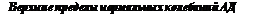

 Причина длительного и устойчивого подъема АД выше верхнего предела диапазона нормальных колебаний у 95 % больных в возрасте от 18 до 65 лет обычно остается не вполне ясной. Таких пациентов считают страдающими от гипертонической болезни, то есть первичной или эссен- циалъной (лат. essentia - сущность) артериальной гипертензии (АГ). При эссенциальной АГ длительный и патологический подъем АД представляет собой первичное звено патогенеза болезни, саму ее сущность, а не является следствием какого-либо другого заболевания. Вторичная артериальная гипертензия представляет собой следствие заболеваний и патологических состояний с вполне ясными этиологией и патогенезом. Среди всех случаев артериальной гипертензии фиксируют следующую частоту видов вторичной АГ:
Причина длительного и устойчивого подъема АД выше верхнего предела диапазона нормальных колебаний у 95 % больных в возрасте от 18 до 65 лет обычно остается не вполне ясной. Таких пациентов считают страдающими от гипертонической болезни, то есть первичной или эссен- циалъной (лат. essentia - сущность) артериальной гипертензии (АГ). При эссенциальной АГ длительный и патологический подъем АД представляет собой первичное звено патогенеза болезни, саму ее сущность, а не является следствием какого-либо другого заболевания. Вторичная артериальная гипертензия представляет собой следствие заболеваний и патологических состояний с вполне ясными этиологией и патогенезом. Среди всех случаев артериальной гипертензии фиксируют следующую частоту видов вторичной АГ:
♦ АГ как следствие заболеваний паренхимы почек - 3-4 %;
♦ почечная сосудистая гипертензия - 0, 5-1 %;
♦ АГ, связанная с гиперфункцией надпочечников (феохромоцитома, первичный альдостеронизм и синдром Кушинга) - 0, 1-0, 3 %;
♦ вторичная АГ в силу других причин - 0, 1-0, 3 %.
Тяжелая и крайне тяжелая артериальная гипертензия часто является вторичной относительно заболеваний почек. У 33 % таких больных выявляют почечную сосудистую (вазоренальную) гипертензию.
У 5 % женщин, постоянно принимающих контрацептивы, содержащие эстрогены, через 5 лет от момента начала их использования диастолическое АД становится выше 90 мм рт. ст. Патогенез такой вторичной АГ остается неясным. Полагают, что эстрогены ускоряют реализацию наследственной предрасположенности к первичной гипертензии и обостряют скрытые дисфункции почек, которые становятся причинами вторичной АГ.
Если АГ развивается в препубертатном периоде у детей, то ее вызывают заболевания с патологическими изменениями паренхимы почек, или она является вазоренальной. В постпубертатном периоде у детей артериальная гипертензия в большинстве случаев первична, но частота вторичной артериальной гипертензии в данный период онтогенеза все равно остается более высокой, чем у взрослых.
ПАТОГЕНЕЗ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНИ
Артериальное давление представляет собой прямую функцию произведения минутного объема кровообращения (МОК) и общего периферического сосудистого сопротивления (ОПСС). Непосредственными причинами патогенного роста артериального давления служат рост МОК и (или) подъем ОПСС. Между МОК и ОПСС существует регуляторная взаимозависимость, которая часто реализуется по принципу отрицательной обратной связи. Например, у многих больных с застойной сердечной недостаточностью действие ингибиторов ангиотензин-превращающего фермента ведет к росту МОК, снижая общее периферическое сосудистое сопротивление и увеличивая фракцию изгнания левого желудочка.
Функциональная система, конечным полезным приспособительным результатом которой является адекватный потребностям организма уровень АД, на пути достижения своего конечного результата как промежуточных полезных результатов достигает оптимальной величины МОК и непатогенного уровня ОПСС, соответствующих потребностям органов, тканей и клеток на периферии.
Если первичный патогенный сдвиг как этиологический фактор гипертонической болезни происходит в какой-либо из двух систем, или в системе поддержания адекватного потребностям организма МОК, или в системах регуляции, ответственных за оптимальный уровень ОПСС, то он всегда приводит к изменениям функционирования и дисфункциям другой системы. Вот почему первоначальные патогенные изменения регуляции и эффекторов как причина эссенциальной АГ часто остаются не вполне ясными, и патогенез первичной артериальной гипертензии при возникновении взаимосвязанных патологических изменений МОК и ОПСС представляет собой уже не специфический механизм болезни, а типовой эндогенизированный патологический процесс.
У большинства пациентов с эссенциальной АГ ведущим звеном ее патогенеза следует признать прогрессирующий от транзиторного до патогенно постоянного повышенный уровень ОПСС. У меньшей части больных всех возрастных групп эссенциальная АГ представляет собой следствие не имеющего биологического смысла возрастания МОК. На этапе развития эссенциальной гипертензии, который можно определить как стадию предболезни первичной АГ, ее признаком у больных в возрасте до 30 лет считают отсутствие реакции снижения ОПСС в ответ на физическую нагрузку. Во время физической нагрузки у людей без предрасположенности к гипертонической болезни ОПСС снижается для удовлетворения потребности в росте объемной скорости кровотока на периферии. У молодых людей с предрасположенностью к гипертонической болезни ОПСС остается на патологически высоком уровне, который можно признать нормальным только для условий покоя. При усилении АГ по мере старения у больных с эссенциальной артериальной гипертензией патологически высокий уровень ОПСС все чаще и чаще представляет собой основную причину подъема АД. По мере прогрессирования гипертонической болезни по ходу онтогенеза, когда АГ становится постоянно умеренной или тяжелой, в 70 % случаев артериальная гипертензия представляет собой следствие стойкого аномального возрастания ОПСС. При этом у пожилых больных МОК в условиях покоя может быть патологически снижен, и нередко возникает застойная сердечная недостаточность. В данном случае причиной падения насосной функции сердца является постоянно повышенная постнагрузка левого желудочка.
Основные этапы развития гипертонической болезни в соответствии с ее нейрогенной теорией можно описать следующим образом:
♦ отрицательный психоэмоциональный стресс расстраивает внутри- центральные отношения таким образом, что на супрасегментном уровне автономной нервной системы возникает устойчивое и повышенное возбуждение симпатических центров;
♦ на периферии через нервную симпатическую стимуляцию сосудистой стенки и гиперкатехоламинемию устойчивое возбуждение симпатических центров приводит к спазму сосудов сопротивления и постоянно высокому уровню ОПСС, который обуславливает АГ;
♦ высокая интенсивность и длительность усиленного сокращения гладкомышечных элементов стенки резистивных сосудов ведут к росту потребления свободной энергии их миоцитами, что служит стимулом для гипертрофии последних;
♦ гипертрофия миоцитов стенки сосудов сопротивления служит одной из причин ее утолщения, которое сужает просвет резистивных сосудов;
♦ сужение сосудов сопротивления придает высокому уровню ОПСС фиксированный характер и делает АГ необратимой;
♦ когда сужение сосудов сопротивления во всем организме захватывает в соответствующей мере и приводящие артериолы почечных нефронов, АГ становится не только нейрогенной и связанной с гипертрофией стенок сосудов сопротивления, но и почечной сосудистой артериальной гипертензией, часто приобретая злокачественный характер.
Нейрогенная теория как концепция прогрессирования гипертонической болезни по мере старения вполне адекватна обычному развитию эс- сенциальной артериальной гипертензии по ходу онтогенеза (схема. 21. 1). Устойчивая активация супрасегментарных симпатических центров как следствие патогенного отрицательного эмоционального стресса и злоупотребления спиртным (алкоголь обладает центральным прессорным действием) повышает АД не только через спазм сосудов сопротивления. Кроме того, преобладание на системном уровне адренергической стимуляции вызывает констрикцию емкостных сосудов, что повышает общий венозный возврат к сердцу и соответственно МОК.
|
Схема 21. 1. Прогрессирование первичной артериальной гипертензии по мере старения |
|
|
|



