|
Патобиохимические сдвиги в плазме крови 1 страница
|
|
|
|
Патобиохимические сдвиги в плазме крови
Звено патогенеза хронической почечной недостаточности
Рост содержания креатинина и фосфатного аниона в сыворотке крови и возрастание АМК
Рост содержания мочевой кислоты в сыворотке крови
Низкое содержание во внеклеточной жидкости и плазме крови бикарбонатного аниона, почечный канальцевый ацидоз
Снижение СКФ
Падение СКФ и секреции мочевой кислоты в просвет канальцев нефронов
Снижение ацидификации мочи вследствие дисфункций канальцев нефрона, то есть недостаточная секреция протонов в просвет канальцев, угнетение образования эпителиоцитами канальцев аммиака, а также синтеза бикарбонатного аниона почками и его тубулярной реабсорбции
К симптомам уремии и экстраренальным осложнениям хронической почечной недостаточности относят:
♦ анемию как результат гемолиза и угнетения гемопоэза;
♦ гастроинтестинальные симптомы и осложнения: анорексию, икоту, тошноту, рвоту, язвы желудка, язвенный колит, эрозивные кровотечения, запор и диаррею, паротит;
♦ неврологические симптомы и осложнения со стороны нервной системы: периферическая нейропатия, зуд, спазмы мышц, эклампсия, кома;
♦ остеомаляцию;
♦ отеки;
♦ артериальную гипертензию.
У больных с уремическим синдромом угнетена способность костного мозга к эритропоэзу, что в частности связывают с утратой почками части клеток, образующих и секретирующих эритропоэтин. Дефицит эритропо- этина ведет к развитию нормохромной анемии. При уремии небольшой гемолиз может вызывать значительную анемию, так как происходит при угнетении эритропоэза. Цитолиз эритроцитов свежей донорской крови, после ее переливания реципиентам с уремическим синдромом, происходит в три раза быстрее, чем у других больных. С другой стороны, эритроциты пациентов с уремией, выступающих в качестве доноров, по времени сохранения функции и циркуляции с кровью реципиентов не отличаются от эритроцитов других доноров. Анемия у больных с уремическим синдромом, часто являясь первым из его элементов, прогрессирует медленно. Из-за гемолиза гемотрансфузии для коррекции анемии у больных с уремией неэффективны.
|
|
|
Вследствие уремии всасывание кальция из просвета кишки становится аномально низким вне зависимости от поступления во внутреннюю среду витамина Б и влияния (витамин 0)-гормона на абсорбцию кальция из просвета кишечника (резистентность кишечного всасывания кальция по отношению к витамину Д). В результате при любых потреблении витамина с пищей и биологической активности (витамин 0)-гормона развивается гипокальциемия, которую не может предотвратить компенсаторное снижение экскреции кальция почками. Кроме как с резистентностью по отношению к витамину О, нарушения всасывания кальция предположительно связывают с высоким содержанием фосфатов в стенке кишки. Высокое содержание фосфатов в кишечной стенке обуславливает связывание ионизированного кальция с образованием нерастворимого кальция фосфата еще до того, как свободный кальций в ходе его кишечного всасывания попадает из просвета кишки в кровь. Это приводит к падению содержания ионизированного кальция в сыворотке крови.
Низкое содержание в организме ионизированного кальция у больных с почечной недостаточностью отчасти является следствием соединения свободного кальция с фосфатным и сульфатным анионами во внеклеточной жидкости. Содержание этих анионов растет во внеклеточной жидкости вследствие падения экскреторной функции почек. Интенсивное образование кальция фосфата во внеклеточной жидкости ведет к внекостной кальцификации тканей в области суставов и позвоночного столба. Внеко- стная кальцификация захватывает паренхиму легких, печени и почек. Соединения кальция откладываются в сосудистой стенке и коже. Оссифика- ция связок и мышц в области суставов, вызывает боль аналогичную той, от которой страдают больные подагрой. Поэтому синдром внекостной кальцификации тканей называют «псевдоподагрой».
|
|
|
Если внекостная кальцификация затрагивает проводящую систему сердца, то это вызывает сердечные аритмии, которые у части больных могут привести к летальному исходу.
Низкая концентрация ионизированного кальция в плазме крови служит стимулом для секреции паратиреоидного гормона. Повышенная секреция паратиреоидного гормона у больных с хронической почечной недостаточностью лежит в основе синдрома вторичного гиперпаратиреоза. Паратиреоидный гормон стимулирует активность остеокластов, что увеличивает резорбцию кальция и фосфатов из костной ткани. Потеря костной тканью кальция фосфата, которую усиливает ацидоз вследствие почечной недостаточности, приводит к ренальной остеодистрофии, при которой образование множественных костных кист обуславливает частые переломы костей.
У небольшого числа больных высокая секреция паратиреоидного гормона сохраняется и после устранения почечной недостаточности пересадкой почки. Это патологическое состояние называют третичным гиперпа- ратиреозом. Для него характерны остеодистрофия и высокое содержание ионизированного кальция в плазме крови. Третичный гиперпаратиреоз у некоторых больных устраняют резекцией паращитовидных желез. В основе синдрома лежит извращение регуляции секреции гормона паращитовидных желез, основанное на принципе положительной обратной связи. При этом секреция гормона продолжает оставаться аномально высокой, несмотря на снижение концентрации ионизированного кальция в сыворотке крови.
ОБСТРУКТИВНАЯ УРОПАТИЯ
Патологическое состояние вследствие механического препятствия выведению мочи и связанной с ним постренальной почечной недостаточности называют обструктивной уропатиеи
|
|
|
Механическое препятствие нормальному выведению мочи может возникать на уровне мочеиспускательного канала, мочевого пузыря, одного или двух мочеточников. Его обычно обуславливают:
♦ сдавление опухолью, которая является результатом клеточного роста в тканях, не составляющих мочевыводящие пути;
♦ сужение их просвета вследствие фиброзных изменений в тканях, окружающих мочевыводящие пути;
♦ обтурация мочевыводящих путей опухолями, по происхождению связанными с мочевыводящими путями;
♦ закупорка мочевыводящих путей почечными камнями;
♦ обтурация сгустком крови;
♦ нарушения регуляции тонуса сфинктеров, стенок мочевого пузыря (нейрогенный пузырь) и мочеточников, связанные с патологической болью, передозировкой адреномиметиков и действием криминальных наркотиков.
У мальчиков нередкой причиной обструкции нормальному мочеиспусканию могут быть задние клапаны мочеиспускательного канала. Более редкие причины обструкции - клапаны мочеточников, а также уретеро- целе, то есть мешковидная дилатация терминальной части мочеточника, выбухающая в просвет мочевого пузыря вследствие врожденного стеноза устья мочеточника.
Обструкция мочеточников резко повышает давление в мочеточниках, почечной паренхиме и канальцах нефронов. Затем при длительной обструкции давление в мочеточниках возвращается на исходный уровень.
Через 15 мин после обструкции мочеточника объемная скорость кровотока в почке, мочевыведение из которой заблокировано, возрастает на 40-50 %. Этот рост кровотока связан с падением почечного сосудистого сопротивления. В дальнейшем за несколько дней объемная скорость кровотока падает до уровня значительно более низкого, чем нормальный. Это двухфазное изменение кровотока связывают с реакцией роста образования в паренхиме почек простагландинов-вазодилятаторов (простациклин и др. ), которую сменяет интенсификация синтеза простагландина-вазо- констриктора тромбоксана.
Под влиянием обструкции падает скорость клубочковой фильтрации, которую снижают: а) рост давления жидкости в просвете канальцев неф- рона как причина падения градиента давлений, обуславливающего фильтрацию в клубочках; б) рост почечного сосудистого сопротивления вследствие высокого уровня образования в почках простациклина.
|
|
|
Если в течение недели обструкцию мочевыведению устраняют, то функции почек восстанавливаются полностью. При большей длительности обструкции возможна потеря почками некоторых из своих функций, несмотря на возвращение скорости клубочковой фильтрации на исходный уровень. После прекращения обструкции, которая длилась шесть недель, скорость клубочковой фильтрации возрастает лишь умеренно, на 10- 20 мл в мин. Длительная обструкция выведению мочи приводит к несахарному мочеизнурению как результату падения концентрационной способности почек и ареактивности тубулярных эпителиоцитов к действию антидиуретического гормона. Кроме того, тубулярный эпителий во многом лишается своих функций, обеспечивающих нормальные синтез в почках аммиака и секрецию протонов в просвет канальцев нефрона. В результате развивается почечный канальцевый ацидоз.
Прекращение продвижения жидкости по мочевыводящим путям и рост давления в их просвете, повреждающий защитные иммунные системы канальцевого эпителия, предрасполагает к инфекциям мочевыводящих путей и почек, которые могут быть причинами некроза почечных сосочков.
После прекращения обструкции наступает полиурия, то есть аномальноусиленное выделение мочи. Выделяют следующие ее причины:
♦ осмотический диурез в силу необходимости для организма выделять те осмоли, которые были задержаны во внутренней среде в результате обструкции выведению мочи;
♦ патологический рост содержания в организме натрия и объема внеклеточной жидкости как причина интенсификации натрийуреза и выведения мочи;
♦ падение реабсорбционной способности почек как причина патологически усиленного натрийуреза;
♦ нефрогенное несахарное мочеизнурение, то есть снижение физиологической реакции на действие антидиуретического гормона.
Если полиурия как результат обструктивной уропатии приобретает патологический характер, то она приводит к падению объема внеклеточной жидкости, гипернатриемии (результат избыточного водного диуреза) и обуславливает гипокалиемию.
Глава 23
ПАТОФИЗИОЛОГИЯ ПЕЧЕНИ
Печень - это орган-эффектор функциональных систем, конечными полезными приспособительными результатами которых являются:
♦ нормальный углеводный и липидный обмен;
♦ детоксикация и экскреция эндогенных и экзогенных метаболитов;
|
|
|
♦ образование и секреция желчи;
♦ уничтожение и элиминация всего чужеродного при прохождении крови через печень посредством функционирования клеток системы мононуклеарных фагоцитов, локализованных в печени.
Кроме того, печень и гепатоциты, образуя глутамин, представляют собой эффекторы системы удержания концентрации протонов во внеклеточной жидкости и клетках в нормальных пределах. Как локус синтеза альбумина печень задействована функциональной системой поддержания нормального коллоидно-осмотического давления плазмы крови. Ненарушенный синтез коагулянтов в печени - необходимое условие нормальной свертываемости крови. Это лишь немногие из функций печени и гепато- цитов, осуществляя которые, они участвуют в функционировании разнообразных систем.
Недостаточность печени как патологическое состояние всего организма, обусловленное недостатком нормальных гепатоцитов, складывается прежде всего из нарушений детоксикации в печени, низкого уровня синтеза белков в гепатоцитах, а также представляет собой следствие падения образования желчи и ее секреции в просвет кишечника. Цирроз печени, снижая общую площадь поперечного сечения печеночных синусоид, ведет к портальной гипертензии и асциту.
Острая печеночная недостаточность - это следствие быстрой (в течение нескольких недель или даже быстрее) потери печенью 90 или более процентов нормальных гепатоцитов. При этом часто не успевает развиться такой частый симптом недостаточности печени как желтуха.
При острой печеночной недостаточности падает утилизация печенью метаболитов, образуемых при осуществлении цикла лимонной кислоты, то есть лактата, пирувата, альфа-кетоглютарата. Эти метаболиты представляют собой органические кислоты, диссоциирующие во внеклеточной жидкости. В результате аккумуляции и диссоциации данных кислот во внутренней среде развивается метаболический ацидоз с увеличенным анионным пробелом плазмы. Метаболический ацидоз через падение общего приферического сосудистого сопротивления приводит у больных в состоянии острой печеночной недостаточности к трудно устраняемой артериальной гипотензии.
ХОЛЕСТАЗ
Холестаз (холестатический синдром) - патологическое состояние организма вследствие падения объемной скорости продвижения желчи по желчевыводящим путям, которое обуславливает снижение секреции желчных кислот и экскреции билирубина в просвет кишечника и аккумуляцию составляющих желчи в циркулирующей крови (табл. 23. 1).
Таблица 23. 1
Патогенез холестатического синдрома
 Симптом и данные специальных исследований
Симптом и данные специальных исследований
Желтуха
Зуд
Обильный рыхлый стул
Белый или светлый стул. Низкое содержание уробилиногена в моче
Экхимоз (частые подкожные кровоизлияния)
Ксантоматоз, то есть кожные умеренно пигментированные (желтоватые) разной консистенции (иногда рыхлые) сходные с папилломами на толстой ножке образования различной локализации
Гепатомегалия, рост активности в крови щелочной фосфатазы, аланин- и апартатаминотрансферазы, патологические изменения гепатоцитов и микроструктуры печени, выявляемые при микроскопии ее биоптата
Рост концентрации билирубина в крови вследствие падения его экскреции в просвет кишечника
Аккумуляция в крови желчных кислот из-за падения их секреции в двенадцатиперстную кишку
Снижение всасывания жиров из просвета кишечника вследствие низкого содержания желчных кислот в его просвете. Рост содержания жиров в кале как причина изменения консистенции и роста массы кала
Отсутствие или снижение содержания в кале желчных пигментов и уробилиногена в результате остановки или снижения объемной скорости продвижения желчи по желчевыводящим путям
Коагулопатия, обусловленная недостаточным всасыванием витамина К из просвета кишечника вследствие холестаза и низкой концентрации желчных кислот в просвете кишки. Нарушение синтеза факторов свертывания в печени из-за вторичных по отношению к холестазу дисфункций гепатоцитов
Рост концентрации холестерина в плазме крови после длительного холестаза
Некробиотические изменения клеток печени как следствие блокады отделения желчи и высокого давления в желчевыводящих путях. Реактивное воспаление с клеточной пролиферацией
В плазме крови и печени содержится фермент лецитин-холестерин- ацилтрансфераза (ЛХАТ), который участвует в превращении свободного холестерина в его этерифицированную форму. Повышение содержания свободного холестерина в сыворотке крови при снижении в ней концен-
трации этерифицированного холестерина у больных с холестазом предположительно связано со снижением образования ЛХАТ печенью. Снижение продукции ЛХАТ связано с появлением в сыворотке крови у больных с холестазом необычного липопротеина низкой плотности, который называют липопротеином X.
В клинической практике о холестатическом синдроме чаще всего свидетельствуют желтуха и рост активности в плазме крови фермента щелочной фосфатазы, синтез которой в печени растет вследствие холестаза. Если, кроме того, происходит осветление стула, а из мочи исчезает уробилиноген, то развитие холестатического синдрома сомнений вызывать не должно.
После выявления у больного холестатического синдрома необходимо исключить или установить механическое препятствие выведению желчи в просвет кишечника (обтурация камнями при желчно-каменной болезни, сдавление или заращение желчевыводящих путей вследствие опухолей печени и поджелудочной железы, стриктура другого происхождения на ка- ком-либо уровне выведения желчи в просвет кишечника и др. ), которое может служить показанием к оперативному вмешательству. Известно, что желчные протоки диаметром более 1 мм обладают исключительной способностью к растяжению под влиянием роста давления в них желчи, связанного с холестазом. В результате растяжения канальцев такого диаметра может возникнуть увеличение объема всей печени. Обычная причина роста массы печени данного происхождения - это обструкция желчевыводящих путей, которая может служить показанием к хирургическому лечению.
Приобретенные расстройства активного транспорта анионов через стенку желчных капилляров - более редкие причины холестаза и крайне редко приводят к холестатическому синдрому, который сохраняется в течение нескольких дней, как это бывает при механическом препятствии выведению желчи в просвет кишечника.
Наиболее частая причина механической обструкции желчевыведению, требующей хирургической коррекции, - это камень желчного пузыря, закупоривший общий желчный проток. Чаще всего камень закупоривает проток в его наиболее узкой и наименее растяжимой части, находящейся в стенке двенадцатиперстной кишки. В результате происходит дилатация проксимальной части общего желчного протока, которую можно выявить при рентгенологическом и ультразвуковом исследовании. Одновременно может расшириться желчный пузырь. Ультразвуковое исследование и компьютерная томография печени позволяют выявить характерное для механического препятствия выведению желчи расширение внутрипеченочных желчных протоков.
У небольшой части больных, и особенно у детей, холестатический синдром представляет собой результат врожденного дефицита молекулярных переносчиков желчных кислот на уровне печеночных синусоид и желчных канальцев (капилляров) или какого-либо другого генетически детерминированного дефекта анионной помпы стенки желчных капилляров. Примером могут служить синдромы Байлера и Аладжилля. При синдроме Аладжилля холестаз сочетается с такими врожденными аномалиями как деформация дуг позвонков и стеноз легочной артерии.
Известно, что эстрогены снижают уровень экскреции как желчных кислот, так и связанного билирубина. Если беременным назначают препараты на основе эстрогенов, то может развиться холестатический синдром. Ведущее звено его патогенеза - это рост под влиянием эстрогенов проницаемости для желчных кислот стенок желчных канальцев. В результате гепатоцит не может посредством активного транспорта создать градиент концентрации желчных кислот между своим цитозолем и просветом желчного канальца.
ЖЕЛТУХА
Желтуха (иктеричность) - желтое окрашивание кожи или склер, обусловленное их пигментацией билирубином при его патологически высоком содержании в крови (гипербилирубинемия). Прежде всего гиперби- лирубинемия приводит к иктеричности склер, так как они содержат много эластина, обладающего высоким сродством к билирубину.
У здорового человека содержание билирубина в плазме крови варьирует от 3 мг/л (5, 1 мкмоль/л) до 10 мг/л (17 мкмоль/л). Большая часть билирубина, который в норме содержит кровь, - это неконъюгированный (несвязанный) билирубин, который в плазме крови находится в соединении с альбумином. Такой нерастворимый в воде билирубин называют непрямым, так как в прямую реакцию Ван-ден-Берга в водной среде вовлечен только водорастворимый прямой (конъюгированный, связанный) билирубин. Большинство врачей легко выявляют желтуху при осмотре больного, когда содержание билирубина в крови выше, чем 20-25 мг/л (34- 42 мкмоль/л). По мере нарастания гипербилирубинемии кожа становится зеленоватой из-за окисления билирубина с образованием биливердина. Окисление прямого билирубина идет быстрее. Поэтому зеленоватый оттенок кожа чаще приобретает при преимущественном росте содержания в плазме крови прямого билирубина.
Сразу же после выявления желтухи или гипербилирубинемии следует выяснить, содержание какого билирубина преимущественно возросло в плазме крови. Отсутствие билирубина в моче свидетельствует, что гипербилирубинемия обусловлена ростом концентрации в плазме крови непрямого билирубина. Неконъюгированный билирубин, будучи связанным с альбумином, при нормальной клубочковой фильтрации не попадает в ультрафильтрат, а значит и в конечную мочу. При гипербилирубинемии, обусловленной повышенным содержанием в плазме крови неконъюгированного билирубина, 80-85 % общего содержания билирубина в плазме составляет непрямой билирубин, что определяют, используя реакцию Ван-ден-Берга. Следует заметить, что при использовании жидкостной хромотографии эта величина возрастает до 96 %. Считают, что гипербилирубинемия в основном обусловлена возрастанием концентрации в крови прямого билирубина, если более 50 % билирубина, который содержит сыворотка, - это прямой билирубин, то есть моно- и диглюкурониды билирубина.
В норме, для того чтобы билирубин поступил в желчь, он должен быть трансформирован из непрямого билирубина в глюкурониды, то есть превращен в прямой (связанный) билирубин (рис. 23. 1). Секрецию прямого билирубина в желчь считают активным процессом, торможение которого может снизить скорость образования конъюгированного билирубина в печени. Если патологический процесс, вызывая дисфункции гепатоци- тов, тормозит секрецию глюкуронидов в желчь, то:
♦ снижается секреция билирубина в желчь;
♦ возникает регургитация, то есть обратный выход прямого (связанного) билирубина из клеток печени в кровоток.
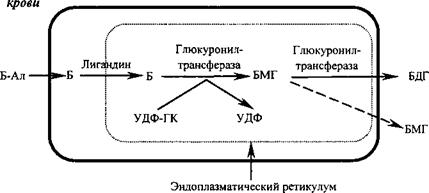
| Плазма Гепатоцит Желчь
Рис. 23. 1. Поглощение непрямого (несвязанного, неконъюгированного) билирубина гепато- цитом, его связывание (трансформация в коньюгированный, связанный) и экскреция в виде прямого билирубина, то есть глюкуронидов билирубина (Б-Ал - непрямой билирубин, циркулирующий с кровью вместе с альбумином; Б - билирубин; УДФ- ГК - уридиндифосфат-глюкуроновая кислота; БДГ - билирубиндиглюкорунид; БМГ - билирубинмоног- люкуронид). |
Желтуху с преобладанием содержания в сыворотке непрямого били- рубина вызывают:
♦ патогенно избыточное образование билирубина;
♦ нарушение поглощения клетками печени непрямого билирубина из циркулирующей крови;
♦ расстройства связывания билирубина глюкуронидами в гепатоцитах.
Избыточное образование билирубина в организме может быть связано
с гемолизом. Под гемолизом понимают состояние организма, которое характеризует падение времени циркуляции с кровью эритроцитов в результате их преждевременного разрушения. При этом эритроциты могут разрушаться как в силу внешних по отношению к ним причин (аутоиммунное поражение эритроцитов и др. ), так и вследствие причин, кроющихся в самих красных кровяных клетках (наследственный сфероцитоз и др. )
Нарушение поглощения билирубина печенью, то есть отщепления пигмента от альбумина и последующее связывание его с лигандином, как причину желтухи могут вызывать некоторые лекарственные средства (препараты флаваспидиновой кислоты и др. ). У некоторых больных с синдромом Жильбера в основе желтухи также лежит нарушение данной фазы обмена билирубина в печени.
Расстройства связывания билирубина глюкуронидом могут быть следствием как приобретенной, так и врожденной недостаточности активности фермента глюкуронилтрансферазы. Ее активность низка у нормального плода и здоровых новорожденных, что служит одной из причин физиологической желтухи между вторым и пятым днями жизни. Умеренное снижение активности энзима выявляют у части больных с синдромом Жильбера. Кроме того, низкий уровень активности фермента лежит в основе врожденной негемолитической желтухи II типа. При врожденной негемолитической желтухе I типа фермента просто нет в печени.
Приобретенное угнетение активности глюкуронилтрансферазы билирубина может быть результатом побочного действия некоторых лекарственных средств (прегнандиола, левомицетина). Заболевания печени, которые приводят к гибели и дисфункциям гепатоцитов (гепатоцеллюляр- ные болезни, то есть гепатит и цирроз), также нарушают связывание билирубина глюкуронидом, но в большей степени вследствие гепатоцел- люлярных болезней падает способность клеток печени и всего органа к экскреции билирубина, что обуславливает желтуху с преобладанием в сыворотке крови прямого билирубина.
Желтуха с преобладанием в сыворотке крови прямого билирубина- это чаще всего результат нарушения экскреции билирубина печенью и ре- гургитации прямого билирубина, обусловленных дисфункциями гепатоцитов, всей печени и (или) холестазом, в том числе и связанным с механическим препятствием желчевыведению. Так как прямой билирубин циркулирует с кровью отдельно от альбумина, то он попадает в состав первичной мочи в ходе клубочковой фильтрации. Билирубин в моче служит доказательством гипербилирубинемии при преобладании в сыворотке крови содержания прямого билирубина. Обтурация общего желчного протока через блокаду перемещения связанного билирубина из гепатоцитов в желчь ведет к регургитации прямого билирубина и росту его содержания в сыворотке крови. Гепатоцеллюлярные болезни угнетают экскрецию билирубина, нарушая функционирование гепатоцитов и снижая число нормальных клеток печени. Поэтому как при гепатоцеллюлярных болезнях, так и при механическом препятствии выведению желчи в сыворотке крови растет содержание прямого билирубина. Для окончательного выявления причины желтухи применяют другие способы диагностики (ультразвуковой и др. ).
Предполагают существование следующих патогенетических механизмов снижения экскреции прямого билирубина печенью:
♦ разрыв желчных канальцев вследствие гибели клеток, составляющих их стенки;
♦ обтурация желчных канальцев густой желчью или их сдавление вследствие отека клеток печени;
♦ сдавление и закупорка холангиол как результат воспалительной инфильтрации;
♦ рост проницаемости наружной клеточной мембраны гепатоцитов;
♦ накопление прямого билирубина в печени и ее клетках, связанное с нарушением обмена билирубина в клетках печени и снижением числа нормальных гепатоцитов, как причина пассивной диффузии прямого билирубина в кровь.
Полная обструкция внепеченочных желчных протоков вызывает желтуху при преобладающем росте содержания в крови прямого билирубина, билирубинурию (появление прямого билирубина в моче) и осветление каловых масс до цвета глины. Так как желчь не поступает в кишечник, то из кала и мочи полностью исчезает уробилиноген. Общая концентрация билирубина в сыворотке крови растет до уровня 300-400 мг/л, после чего рост прекращается. Это можно связать с установлением равновесия между выведением билирубина с мочой и его трансформацией на путях метаболизма.
Частичная обструкция внепеченочных желчных протоков вызывает желтуху только тогда, когда давление внутри желчных протоков растет до величины максимального давления секреции желчи, составляющего примерно 250 мм рт. ст. Поэтому при частичной обструкции желтуха, били- бинурия и каловые массы цвета глины встречаются не всегда. Желтуха может развиться и при более низком давлении, если возникает инфекция желчных протоков и связанные с ней дисфункции гепатоцитов.
НАРУШЕНИЯ ОБМЕНА ВЕЩЕСТВ КАК РЕЗУЛЬТАТ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ
Исключительно в печени синтезируются многие из молекулярных эффекторов функций, без которых невозможна нормальная работа ряда функциональных систем (табл. 23. 2). Поэтому потеря печенью определенного числа нормально функционирующих гепатоцитов приводит к специфическому для определенных систем дефициту массы на уровне эффекторов и к разнообразным системным патологическим сдвигам вследствие расстройств функциональных систем.
Таблица 23. 2
Некоторые из протеинов, синтезируемые исключительно в печени
1. Альбумин
2. Факторы свертывания крови
а. Фибриноген (фактор I)
б. Протромбин (фактор II)
в. Факторы III, V, VII, IX, X, XI
3. Транспортные белки
а. Гаптоглобин
б. Трансферрин
в. Церуллоплазмин
г. Белки с функциями переносчиков гормонов
д. Липопротеины низкой плотности
Холестерин - это главная составляющая желчи, а также предшественник желчных солей и стероидных гормонов на пути их синтеза. Кроме того, холестерин представляет собой интегрирующий компонент клеточных мембран, основными структурными элементами которых являются фосфолипиды и белки. Гепатоциты поглощают холестерина больше, чем любые другие клетки организма. Холестерин поглощается гепатоцитами для синтеза в дифференцированных клетках печени желчных солей, а также для последующего высвобождения гепатоцитами в кровь холестерина, связанного с атерогенными липопротеинами низкой плотности. В этой связи нормальное функциональное состояние гепатоцитов и всей печени можно считать необходимым условием удержания концентрации холестерина в сыворотке крови в нормальных пределах.
Одновременно с утилизацией холестерина гепатоциты сами образуют его как для собственных нужд, так и для удовлетворения потребностей всего организма. Поэтому содержание холестерина в сыворотке крови представляет собой результат соотношения синтеза холестерина в печени и кишечнике и его экскреции печенью вместе с желчью.
Если гепатоцеллюлярные болезни снижают число нормальных гепатоцитов до определенного уровня, то падение синтеза холестерина в печени преобладает над снижением его экскреции в просвет кишечника таким образом, что в сыворотке крови падает концентрация холестерина.
|
|
|