|
Первый (I) инсулинзависимый. Второй (И) неинсулиизависимый. Гипоталамо-гипофизарная система регуляции роста тела
|
|
|
|
Первый (I) инсулинзависимый
Второй (И) неинсулиизависимый
Частота в основной популяции
Возраст больных при возникновении заболевания
Наследственная пред- расположенность
Генетические маркеры предрасположенности к заболеванию
Аутоиммунный механизм развития болезни
Конституция больных
Нарушения обмена веществ
Основной элемент терапии
0, 2-0, 5 %, частота среди мужчин и женщин одинакова
Меньше 25 лет
Частота инсулинзависимого сахарного диабета у родственников пробанда первой степени меньше, чем 10 %; вероятность болезни у гомозиготного близнеца (брата, сестры пробанда) составляет 50%
Гены (антигены) из системы генов (антигенов) лейкоцитов человека В8, В15, БЮ, 0114
У части больных с кровью циркулируют аутоантитела к антигенам инсулинпродуцирующих клеток островков Лангерганса и другим аутоантигенам
Масса тела часто снижена, низкое общее содержание жировой ткани и триглицеридов в теле
Тенденция к развитию метаболического кетоацидоза; патологически низкая секреция инсулина
Инсулин, вводимый парентерально
2-4 %, женщины болеют чаще, чем мужчины
Больше 40 лет
Частота заболевания у родственников пробанда первой степени больше, чем 20 %; вероятность болезни у гомозиготного близнеца находится на уровне 90-100 %
Нет
Нет
У 80 % больных выявляют ожирение при массе тела, превышающей 115 % идеальной расчетной
Метаболический кетоаци- доз не развивается; секреция инсулина может быть повышенной, нормальной или патологически низкой
Диета и физическая активность для снижения массы тела
Вторичный сахарный диабет - это патологическое возрастание концентрации глюкозы в плазме крови, обусловленное не сахарным диабетом, а другим патологическим состоянием.
|
|
|
Вторичный сахарный диабет может быть следствием патогенно избыточного питания, особенно с высоким потреблением углеводов. Вероятность гипогликемии выше, если переедание происходит одновременно со снижением физической активности.
Снижение образования эндогенного инсулина как причину вторичного сахарного диабета вызывают:
♦ разрушение инсулин-продуцирующих клеток в результате побочного действия таких лекарственных средств как стрептозоцин и пентамидин;
♦ обратимое угнетение секреции инсулина под влиянием лекарственных средств (диазоксид, диуретики из группы тиазидов, фенитоин);
♦ гипокалиемия и (или) гипомагниемия.
Кроме того, вторичный сахарный диабет может возникать в результате тяжелых и хронических инфекций, воспаления, тяжелой ишемии и инфаркта миокарда, травмы, хирургических вмешательств, отрицательного эмоционального стресса как причин избыточно патогенной активации нейроэндокринной катаболической системы, приводящей к превалированию на системном уровне эффектов катаболических гормонов антагонистов инсулина. В данном случае вторичный сахарный диабет является следствием патологической резистентности к эффекту инсулина на уровне экспрессии генома клеток.
Беременность и побочное действие препаратов на основе эстрогенов, в том числе и пероральных контрацептивов, также могут приводить ко вторичному сахарному диабету через развитие патологической резистентности к действию инсулина на клетки и ткани. Патологическая резистентность по отношению к действию инсулина может быть результатом побочного действия адреномиметиков и препаратов на основе никотиновой кислоты.
ЭТИОЛОГИЯ САХАРНОГО ДИАБЕТА
Можно считать, что этиология сахарного диабета до сих пор остается неясной. Тем не менее, в зависимости от этиологии каждый тип сахарного диабета как отдельную нозологическую форму можно определить следующим образом:
|
|
|
Сахарный диабет первого типа - это мультифакториальная (поли- генная) болезнь, которая, часто являясь аутоиммунным заболеванием, может быть связана с генетическими маркерами из системы антигенов лейкоцитов человека, другими аутоиммунными болезнями; инсулинзависимый сахарный диабет - это во многом результат взаимодействия между собой элементов генома, приводящего к инсулинопении.
Сахарный диабет второго типа - полигенное заболевание, во многом зависящее от кумуляции в организме последствий взаимодействия с внешними этиологическими факторами. К таким последствиям следует отнести длительное избыточное поступление в организм источников свободной энергии вместе с нутриентами, гиподинамию, а также хронический отрицательный психоэмоциональный стресс.
Можно предположить, что взаимодействие элементов генома, обуславливающее предрасположенность к сахарному диабету второго типа, детерминирует и высокую предрасположенность к ряду распространенных полигенных болезней: первичной артериальной гипертензии, атеросклерозу, ишемической болезни сердца, а также ожирению.
Неинсулинзависимый сахарный диабет нельзя считать полигенной болезнью, обусловленной исключительно патологической резистентностью по отношению к инсулину. Об этом свидетельствуют результаты последних экспериментальных исследований роли генетического фактора в развитии сахарного диабета второго типа, объектом которых стали две линии трансгенных мышей. У животных первой линии в геноме отсутствовал ген первого субстрата инсулинового рецептора, а у мышей второй линии генетический материал не содержал гена глюкокиназы бета-клеток островков Лан- герганса, от активности которого зависит синтез инсулина. И у той и у другой линии мышей не было патологической толерантности по отношению к глюкозе. Она появилась у потомства мышей двух линий, генотип которого определял патологическую резистентность клеток-эффекторов по отношению к действию инсулина (отсутствие гена первого субстрата инсулинового рецептора) и обуславливал недостаточность секреции инсулина в ответ на рост концентрации глюкозы во внеклеточной жидкости и крови через низкую активность глюкокиназы бета-клеток.
|
|
|
Результаты данного эксперимента еще раз подтвердили то, что неинсулинзависимый сахарный диабет является полигенной болезнью, наследственная предрасположенность при которой складывается из генетически детерминированных патологической резистентности по отношению к инсулину и недостаточности секреции инсулина. При этом нельзя исключить из патогенеза неинсулинзависимого сахарного диабета следующего порочного круга: раз возникнув, гипергликемия сама по себе становится фактором прогрессирования возрастания концентрации глюкозы в крови через угнетение секреции инсулина и усиление патологической резистентности по отношению к действию гормона.
ПАТОЛОГИЧЕСКАЯ РЕЗИСТЕНТНОСТЬ
ПО ОТНОШЕНИЮ К ИНСУЛИНУ
Резистентность по отношению к инсулину характеризует отсутствие нормальной реакции снижения концентрации глюкозы в крови в ответ на рост содержания в ней инсулина. Выделяют три уровня резистентности по отношению к инсулину:
♦ пререцепторный,
♦ рецепторный,
♦ пострецепторный.
Резистентность по отношению к инсулину на пререцепторном уровне обуславливают:
♦ патологические изменения гормона,
♦ взаимодействие инсулина в качестве носителя аутоантигенов с аутоантителами,
♦ выброс клетками поджелудочной железы в кровь проинсулина вместо инсулина,
♦ блокада нормального взаимодействия гормона со своим рецептором на поверхности клеток.
При хронической почечной недостаточности и уремическом синдроме через действие механизма неспецифического антагонизма расстраивается взаимодействие нормального инсулина со своим нормальным рецептором. Одновременно патологически низкое содержание ионизированного кальция во внеклеточной жидкости и жидкой части плазмы крови как элемент уремического синдрома увеличивает выброс в кровь проинсулина, который не обладает свойствами главного анаболического гормона, вместо инсулина. Таков патогенез пререцепторной резистентности по отношению к инсулину у больных с уремическим синдромом.
|
|
|
Пререцепторная резистентность по отношению к инсулину составляет ведущее звено патогенеза сахарного диабета, который возникает одновременно с проявлениями повышенной секреции андрогенов (опухоли яичников и их поликистоз, а также гипертекоз, то есть диффузная гиперплазия текоцитов граафова фолликула) после полового созревания у девочек. Данный синдром получил название гиперандрогенной резистентности по отношению к инсулину. У больных с гиперандрогенной резистентностью по отношению к инсулину гормон инактивируется вследствие связывания с его эпитопами паратопов аутоантител.
У части больных пререцепторная резистентность по отношению к инсулину представляет собой моногенную болезнь, при которой патогенная мутация, закрепившаяся в ряду поколений, обуславливает врожденный патогенный дефект строения молекулы инсулина.
Резистентность по отношению к инсулину на рецепторном уровне может быть следствием:
♦ низкого уровня связывания гормона со своими рецепторами из-за врожденных аномалий инсулиновых рецепторов (ряд редких моно- генных заболеваний),
♦ низкой экспрессии инсулиновых рецепторов на поверхности соответствующих клеток (во многом детерминируемое генотипом патологическое состояние систем регуляции обмена веществ),
♦ аутоиммунного поражения рецепторов.
Инсулиновый рецептор представляет собой мембранный гетеродимер, состоящий из альфа- и бета-цепей, который после соединения с инсулином приобретает активность тирозинкиназы. Врожденный дефицит инсулиновых рецепторов может быть результатом патогенных мутаций:
♦ изменения последовательности пар нуклеотидов дезоксирибонуклеиновой кислоты, приводящего к потере рецептором домена тирозинкиназы;
♦ точечной мутации как причины отсутствия в рецепторе локуса связывания аденозинтрифосфата и др.
У больных с синдромом гиперандрогенного инсулинрезистентного черного акантоза аутоиммунное поражение инсулиновых рецепторов - это ведущее звено патогенеза сахарного диабета, действие которого у части пациенток с данным синдромом не приводит к явному сахарному диабету. Синдром выявляют у 5 % женщин с гирсутизмом, то есть излишним оволосением тела. При данном синдроме нередкими являются кистозное перерождение яичников, а также патологически высокие концентрации в крови тестостерона и андростендиона наряду с черным акан- тозом. Черный акантоз (acanthosis nigricans) - дерматоз в виде бархатистых бородавчатых разрастаний и гиперпигментации кожи, подмышечных впадин, шеи, анальной области, паха.
|
|
|
Инсулин - это полипептидный гормон, составляющие который аминокислотные цепи, связаны между собой дисульфидной связью. Инсулин как главный анаболический гормон и антагонист катаболических гормонов стимулирует экспрессию генов глицеральдегид-3-фосфат дегидрогеназы, глюкокиназы, альфа-амилазы и тормозит экспрессию гена ключевого фермента глюконеогенеза фосфоенолпируваткарбоксикиназы. Механизм действия инсулина как гормона, модулирующего экспрессию генов клетки, неизвестен, но ясно, что инсулин действует через систему белковых сериновых киназ (ферментов, катализирующих превращение профермента в фермент), то есть киназы ацетил-коэнзим А-карбоксилазы, киназы клеточного микроканальцевого протеина-2, протеинкиназы С и других киназ. В этой связи становится ясным, что принципиально возможно извращение действия инсулина на геном клеток на различных уровнях функционирования той или иной киназы как причина пострецеп- торной резистентности по отношению к инсулину.
При неинсулинзависимом сахарном диабете пострецепторная резистентность по отношению к инсулину может быть ведущим звеном патогенеза. При этом аномалия реакции генома клеток на системном уровне по отношению к инсулину в основном складывается из нарушений синтеза гликогена в миоцитах скелетных мышц, то есть главного механизма аккумуляции избытка глюкозы в организме как у больных сахарным диабетом, так и в физиологических условиях. Предположительно свою роль в снижении реакции усиления образования гликогена в миоцитах скелетных мышц в ответ на действие инсулина может играть извращение его действия на белковые фосфатазы первого типа, активность которых в клетке во многом определяет уровень образования в ней гликогена. Инсулин активирует данные белковые фосфатазы через фосфорилирование (дефосфорилирова- ние) определенных сериновых аминокислотных остатков.
Нарушенная толерантность по отношению к глюкозе - это патологическое состояние, при котором концентрация глюкозы в сыворотке крови выше, чем у здоровых людей, но ниже, чем у больных сахарным диабетом.
При выявлении сахарного диабета нередко определяющее значение имеет тест толерантности (переносимости) глюкозы. Исходным моментом теста является определение концентрации глюкозы в сыворотке крови через два часа после приема пищи или приема стандартной дозы глюкозы (75 г). О патологически низкой толерантности глюкозы свидетельствует концентрация глюкозы в сыворотке крови через два часа после приема пищи (стандартной дозы глюкозы) не меньшая, чем 140 мг/дл. Содержание глюкозы в сыворотке не меньшее, чем 200 мг/дл, - это признак развития сахарного диабета. Предпочтительней исследовать концен
трацию глюкозы в сыворотке крови после приема пищи, чем определять ее в пробе крови, взятой у больных утром, до завтрака. Дело в том, что по мере развития у больных явного сахарного диабета способность концентрации глюкозы в сыворотке крови возвращаться в нормальные пределы через два часа после приема пищи теряется быстрее, чем возникает гипергликемия утром и натощак.
После соблюдения больным в течение трех дней нормальной диеты, при которой больной потребляет с пищей минимум 150 мг углеводов в день, пациент принимает внутрь 75 г глюкозы. Для выполнения теста (табл. 27. 2) исследуется концентрация глюкозы в крови до приема стандартной дозы глюкозы, а затем через 30, 60, 90 и 120 мин после приема.
| Таблица 27. 2 Тест толерантности глюкозы
|
ПАТОГЕНЕЗ ГИПЕРГЛИКЕМИИ И ДРУГИХ НАРУШЕНИЙ ОБМЕНА ВЕЩЕСТВ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
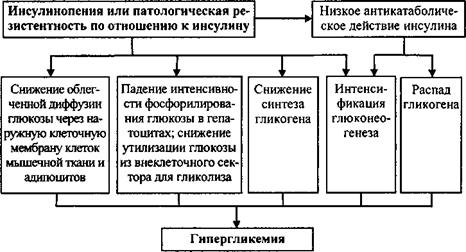
Концентрация свободной глюкозы в клетках значительно выше ее содержания во внеклеточном секторе. Известно, что скорость переноса глюкозы через наружную клеточную мембрану мио- и адипоцитов представляет собой детерминанту интенсивности фосфорилирования глюкозы в клетках. О-глюкоза и другие сахара проникают в клетки путем облегченной диффузии, опосредованной переносчиком. Инсулин усиливает трансмембранный перенос глюкозы, увеличивая число переносчиков, активно функционирующих на уровне плазматической мембраны. Недостаточная концентрация нормального инсулина в циркулирующей крови, нарушения взаимодействия гормона со своим рецептором приводят к снижению числа переносчиков глюкозы, функционирующих на уровне плазматической мембраны. В результате падает транспорт глюкозы в клетки жировой и мышечной ткани, что повышает содержание глюкозы во внеклеточном пространстве и обуславливает гипергликемию.
Инсулин не усиливает облегченной диффузии глюкозы в гепатоци- ты, но увеличивает приток глюкозы в дифференцированные клетки печени через рост активности в них глюкокиназы, одного из ключевых ферментов гликолиза, превращающего глюкозу в глюкозо-6-фосфат. Инсулин, стимулирующий экспрессию гена данного энзима, повышает содержание глюкокиназы в гепатоцитах, что интенсифицирует гликолиз и снижает содержание свободной глюкозы в клетках печени. В результате растет свободная диффузия глюкозы из внеклеточного сектора в гепатоциты. При инсулинопении или патологической резистентности по отношению к инсулину на уровне гепатоцитов в них падает фосфорили- рование глюкозы. В результате растет содержание свободной глюкозы в дифференцированных клетках печени и падает ее свободная диффузия в гепатоциты. Это повышает содержание глюкозы во внеклеточном секторе и служит одним из факторов гипергликемии у больных сахарным диабетом. ,
Кроме того, инсулин усиливает интенсивность гликолиза в печени и других органах вследствие того, что повышает активность в них других его ферментов, фосфофруктокиназы и пируваткиназы. Одновременно инсулин подавляет в гепатоцитах активность глюкозо-6-фосфатазы, что повышает концентрацию в них глюкозо-6-фосфата. В результате действия инсулина глюкоза удерживается в клетках печени, так как их наружная мембрана непроницаема для глюкозо-6-фосфата. Снижение содержания инсулина в крови и (или) патологическая резистентность по отношению к инсулину через повышение активности глюкозо-6-фосфатазы снижают удержание глюкозы в гепатоцитах в виде глюкозо-6-фосфата. Это может быть одним из факторов гипергликемии.
Инсулин, повышая активность гликогенсинтетазы, усиливает образование гликогена на системном уровне. Поэтому инсулинопения и патологическая резистентность по отношению к инсулину снижают утилизацию глюкозы из внеклеточного сектора для синтеза гликогена и тем самым обуславливают гипергликемию.
Под влиянием инсулина происходит избирательное ингибирование транскрипции гена, кодирующего фосфоенолпируваткарбоксикиназу, ключевой фермент глюконеогенеза. В результате инсулинопении или патологической резистентности к инсулину глюконеогенез растормаживается, что повышает высвобождение глюкозы печенью и ведет к гипергликемии.
Итак, патогенез гипергликемии у больных сахарным диабетом весьма сложен и не сводится только к низкой облегченной диффузии глюкозы через наружную клеточную мембрану клеток мышечной и жировой ткани (схема. 27. 1). Свою роль в развитии гипергликемии у пациентов с сахарным диабетом играют превалирующие на системном уровне эффекты ка- таболических гормонов антагонистов инсулина в виде торможения синтеза гликогена и усиления гликогенолиза.
|
Схема 27. 1. Патогенез гипергликемии у больных сахарным диабетом |
Инсулинопения и патологическая резистентность по отношению к инсулину через снижение анаболического эффекта инсулина и его антиката- болического действия обуславливают стойкое падение процессов анаболизма, в том числе липогенеза и белкового синтеза. Одновременно в мышечные и другие клетки вследствие недостаточного системного эффекта инсулина падает транспорт аминокислот, катионов калия и кальция, нук- леозидов и органического фосфата как субстратов анаболизма. Снижение белкового синтеза у больных сахарным диабетом захватывает и систему иммунитета, что служит одной из причин иммунодефицита, вторичного по отношению к сахарному диабету. Падение анаболизма и связанная с ним интенсификация липолиза и распада белков у больных инсулинзависимым сахарным диабетом, возникшим в детском возрасте, может обусловить задержку роста тела. После возникновения инсулинзависимого сахарного диабета у взрослых болезнь приводит к снижению массы тела.
Предположительно инсулин влияет на образование атерогенных ли- попротеинов или снижает очищение от них плазмы крови. Очевидно падение этого эффекта гормона у больных сахарным диабетом приводит к ускоренному атеросклерозу.
Морфопатогенез атеросклероза у больных сахарным диабетом не отличается от патогенетических механизмов атеросклеротических патологических измененеий сосудистой стенки у пациентов, не страдающих от сахарного диабета. И в том и в другом случае патогенные межклеточные взаимодействия в основном складываются из аномального изменения функционального состояния эндотелиоцитов, адгезии к ним активированных мононуклеарных фагоцитов сосудистой стенки, за которой следует прилипание агрегатов активированных тромбоцитов. Агрегаты этих активированных клеток становятся источником цитокинов со свойствами факторов клеточного роста, что обуславливает пролиферацию гладкомышечных миоцитов сосудистой стенки как этапа формирования атеросклеротической бляшки. Многие из факторов риска атеросклероза, гиперхоле- стеринемия, патогенно низкая концентрация в крови липопротеинов высокой плотности, курение и артериальная гипертензия одновременно представляют собой факторы риска сахарного диабета второго типа. Факторы риска атеросклероза, связанные исключительно с сахарным диабетом, - это гипергликемия, гиперинсулинемия (патологически высокая концентрация инсулина в крови у больных сахарным диабетом второго типа, преимущественно обусловленным патологической резистентностью по отношению к инсулину), а также гипертриглицеридемия.
ПАТОГЕНЕЗ ДИАБЕТИЧЕСКОЙ МИКРОАНГИОПАТИИ
В настоящее время не вызывает сомнений, что именно гипергликемия является основной причиной патологических изменений сосудов у больных с длительным инсулинзависимым сахарным диабетом. Тем не менее, патогенез диабетической ангиопатии вследствие гипергликемии остается неясным. Так как глюкоза и ее метаболиты выступают субстратами на различных путях метаболизма, то ангиопатический эффект гипергликемии реализуется несомненно через действие множества патогенетических механизмов. В последние десятилетия были предложены четыре теоретических модели действия таких механизмов:
♦ связанный с активностью альдозоредуктазы (сорбитоловый путь);
♦ через изменение активности протеинкиназы С;
♦ неферментного гликолизирования;
♦ в результате нарушений окислительно-восстановительного потенциала тканей.
В большинстве тканей организма глюкоза может трансформироваться в сорбитол через активность альдозоредуктазы. Из-за высокой константы Михаэлиса[6] альдозоредуктазы для глюкозы уровень синтеза сорбитола при низкой концентрации углевода в клетках невысок. При гипергликемии растет содержание глюкозы в клетках, в которые углевод проникает путем обычной, а не облегченной диффузии, усиливаемой инсулином. В результате в клетках усиливается образование сорбитола. После образования сорбитола возможна его метаболизация, связанная с активностью сорбитолдегидрогеназы, в результате которой образуются фруктоза и восстановленный никотинамидадениндинуклеотид (ЫАОН). Однако пре
вращение сорбитола во фруктозу и ЫАЭН идет медленно, и сорбитол накапливается в клетках. Рост содержания сорбитола в клетках (в частности в нейронах) приводит к их отеку вследствие миграции воды из внеклеточного сектора в сторону большей осмотической концентрации сорбитола.
Предполагают, что накопление сорбитола в клетках хрусталика глаза больного инсулинзависимым сахарным диабетом приводит к образованию у таких пациентов диабетической катаракты.
Так как возрастание концентрации сорбитола в нейронах и клетках мышечной ткани не может привести к их значительному отеку и обусловить цитолиз, то аккумуляцию сорбитола нельзя признать ведущим механизмом диабетических ангио- и нейропатий.
Полагают, что связанный с инсулинопенией рост в клетках и тканях концентрации свободной глюкозы и сорбитола может быть причиной увеличения содержания в них миоинозитола как причины диабетической ангиопатии. Это может быть только предположением, ибо известно, что рост концентрации миоинозитола вследствие инсулинопении, гипергликемии и высокой активности альдозоредуктазы преимущественно происходит в клетках нервной ткани. В эксперименте ингибиторы альдозоредуктазы снижают содержание миоинозитола только в нейронах. Одновременно с ростом содержания в нейронах миоинозитола в них снижается активность натрий-калий-АТФазы. Полагают, что снижение активности натрий-калий-АТФазы также представляет собой следствие накопления в нейронах сорбитола, так как ее активность восстанавливается под влиянием ингибиторов активности альдозоредуктазы.
Были получены обнадеживающие результаты экспериментального изучения ингибиторов альдозоредуктазы как средств коррекции диабетических ангио- и нейропатии. Тем не менее, клинические испытания не принесли ожидаемых результатов, которые бы свидетельствовали о возможности предупреждения диабетических ретино- и нейропатии через действие ингибиторов альдозоредуктазы.
Не исключено, что гипергликемия вызывает диабетическую микроан- гиопатию через патологические изменения обмена фосфолипидов и активности протеинкиназы С. Некоторые из фосфолипидов и данный фермент, функционируя в качестве агентов системной и паракринной регуляции, оказывают на функциональное состояние сосудов и его характеристики (проницаемость сосудистой стенки, сократимость ее гладкомышечных элементов, экспрессия тромбогенного потенциала эндотелиоцитов, объемная скорость кровотока, внутренняя секреция, синтез составляющих базальной мембраны) широкий спектр, в том числе и разнонаправленных влияний. Иными словами, данные системы регуляции клеток на уровне сосудистой стенки контролируют те функции ее клеточных элементов, расстройства которых и служат причинами диабетической ангиопатии. Предположительно повышение активности протеинкиназы С, вызывающее патогенную разностороннюю модуляцию функционального состояния микрососудов, может быть ведущим звеном патогенеза диабетической микроангиопатии. В пользу этого предположения говорит факт высокой активности протеинкиназы С в сетчатой оболочке глаз пациентов, страдающих от инсулинзависимого сахарного диабета и диабетической ретинопатии; кроме того, известно, что у таких пациентов активность данного фермента аномально высока в стенке аорты, кардиомиоцитах, а также в почечных клубочках. Экспериментальные исследования сахарного диабета показали, что инсулинопения и гипергликемия ведут к росту активности протеинкиназы С в стенках сосудов сетчатой оболочки глаза, аорты, почечных клубочков и венечных артерий. Одновременно с ростом активности энзима в клеточных элементах сосудистой стенки определяли возрастание уровня содержания диацилглицерола.
Это позволяет предположить, что инсулинопения и гипергликемия повышают активность протеинкиназы через увеличение содержания в клетках диацилглицерола, одна из функций которого - это усиление перемещения протеинкиназы С из неактивного пула фермента в цитозоле в его активный мембранный пул. Полагают, что изменения активности протеинкиназы С, связанные с сахарным диабетом и гипергликемией, происходят преимущественно в сосудистой стенке, где вследствие инсулинзависимого сахарного диабета растет активность специфической для сосудистой стенки бета-И-протеинкиназы С. В основном рост активности протеинкиназы С меняет функциональное состояние сосудистой стенки посредством модуляции экспрессии генов эндотелиальных и других клеток сосудистой стенки.
Данные, полученные при экспериментальном исследовании влияний гипергликемии на обмен веществ, свидетельствуют, что рост активности протеинкиназы С вследствие гипергликемии не связан с изменением осмо- ляльности внеклеточной жидкости и со сдвигами в обмене сорбитола.
Обусловленные гипергликемией рост содержания диацилглицерола и активности протеинкиназы С при инсулинзависимом сахарном диабете возникают не сразу и не сразу подвергаются обратному развитию после устранения гипергликемии. Тут мы имеем дело еще с одним проявлением общей для развития патологических процессов закономерности, то есть тенденции к эндогенизации - относительной потери связи источников их развития с первичным причинным фактором. Причина эндогенизации в данном случае состоит в том, что протеинкиназа С, комплексно меняя экспрессию генома клетки формирует патологическую систему взаимодействия элементов генетического материала клетки как причины перси- стирования диабетической ангиопатии (это всего лишь наше предположение - В. Ю. Шанин).
Полагают, что гипергликемия вызывает патогенные межклеточные взаимодействия как причину диабетической ангиопатии через образование соединений на основе ковалентных связей глюкозы с ингредиентами клеточных мембран и (или) циркулирующими с кровью липопротеинами и белками. Процесс образования таких соединений называют неферментным гликолизировсшием. Через соединение глюкозы ковалентными связями с аминогруппами протеинов клеточных мембран, ядерных белков и дезоксирибонуклеиновой кислоты происходит образование так называемых транзиторных промежуточных продуктов неферментного гликоли- зирования. Эта реакция достигает своего равновесия за несколько недель. В дальнейшем промежуточные продукты неферментного гликолизирова- ния служат субстратами для образования конечных продуктов неферментного гликолизированш. С образованием конечных продуктов неферментного гликолизирования реакция становится необратимой. Конечные продукты неферментного гликолизирования могут обуславливать патогенную модуляцию экспрессии генома клеток сосудистой стенки как причину диабетической микроангиопатии. Кроме того, они служат субстратами образования свободных кислородных радикалов, которые повреждают наиболее в функциональном отношении активные фосфолипиды клеточных мембран и еще в большей степени стабилизируют конечные продукты неферментного гликолизирования.
Конечные продукты неферментного гликолизирования образуются во внеклеточном пространстве через соединение глюкозы ковалентными связями с липопротеинами низкой плотности, альбумином и гемоглобином. Образование конечных продуктов неферментного гликолизирования на поверхности клеточных мембран меняет их механические свойства, повышая жесткость мембраны. В результате плазматическая мембрана эритроцитов становится более ригидной, что снижает деформируемость эритроцита как необходимое условие нормальной микроциркуляции (незатрудненного прохождения эритроцитов по микрососудам и капиллярам). Эритроциты с патологически низкой вследствие гипергликемии и неферментного гликолизирования деформируемостью при прохождении по микрососудам активируют эндотелиальные клетки через усиленное трение о часть их наружной мембраны, обращенной в просвет микрососуда. Активация эндотелиоцитов служит первым этапом патогенных межклеточных взаимодействий, приводящих к диабетической микроангиопатии.
Кроме того, звеном патогенеза диабетической микроангиопатии является утолщение базальной мембраны капилляров в результате образования входящим в ее состав коллагеном и глюкозой конечных продуктов неферментного гликолизирования, при котором молекулярные цепочки, составляющие коллаген, соединяются между собой попереречными связями в виде молекул глюкозы. В результате базальная мембрана не только утолщается. В ней падает содержание протеогликанов, а функционирование интегриновых рецепторов сосудистой стенки меняется таким образом, что возникают дисфункции всех ее клеточных элементов.
Интенсивность образования конечных продуктов неферментного гликолизирования представляет собой прямую функцию длительности гипергликемии и степени патологического возрастания концентрации глюкозы в циркулирующей крови.
При длительной гипергликемии конечные продукты неферментного гликолизирования (КПНфГ) начинают циркулировать с кровью и фиксируются на наружной поверхности ее мононуклеарных фагоцитов, которая содержит рецепторы специфические по отношению к КПНфГ. В результате происходит системная активация мононуклеарных фагоцитов, циркулирующих с кровью. Активированные мононукпеары начинают высвобождать такие цитокины как фактор некроза опухолей, интерлейкин-1, что приводит к гиперцитокинемии. Гиперцитокинемия через системные активацию эндотелиоцитов и рост экспрессии их тромбогенного потенциала вызывает диабетическую микроангиопатию на уровне всего организма.
Если атеросклероз считать результатом хронического воспаления сосудистой стенки, основным клеточным эффектором которого являются активированные клетки системы мононуклеарных фагоцитов, то гиперци- токинемию вследствие активации мононуклеаров в результате воздействия на них КПНфГ можно предположительно признать фактором ускорения атеросклероза у больных сахарным диабетом и диабетической микро- ангиопатией.
Длительная гипергликемия и неферментное гликолизирование приводят к образованию связей в виде молекул глюкозы, связанных с аминогруппами, между цепочками нуклеотидов дезоксирибонуклеиновой кислоты (ДНК). Это вызывает дисфункции генетического материала эндотелиоцитов, обусловленные изменением строения двойной спирали ДНК, что предположительно можно считать еще одним фактором диабетической микроангиопатии.
В эксперименте было показано, что инфузия растворов, содержащих конечные продукты неферментного гликолизирования, вызывает характерные для диабетической микроангиопатии утолщение базальной мембраны микрососудов и патологические изменения сократимости гладкомышечных элементов сосудистой стенки. При этом ослабляется физиологическая реакция расширения сосудов в ответ на действие такого медиатора как оксид азота. В этой связи были сделаны предположения о механизме ускоренного развития тяжелой первичной артериальной гипертензии у больных сахарным диабетом и длительной гипергликемией, который состоит в потере гладкомышечными клетками сосудистой стенки нормальной реактивности по отношению к расширяющему сосуды действию оксида азота.
Обусловленный гипергликемией рост утилизации глюкозы как субстрата гликолиза или образования полиола увеличивает отношение содержания в клетке восстановленной формы никотинамидадениндинукле- отида к его окисленной форме (ЫАОН/ИАЕ)). Предполагают, что рост содержания в клетке ИАОН представляет собой следствие интенсификации обмена сорбитола и утилизации глюкозы в реакциях пентозного шунта, что в частности приводит к образованию 1, 3-дифосфоглицерата. Рост ЫАОН/ЫАО патогенно влияет на клеточные функции через патологические изменения а) синтеза диацилглицерола, б) функционирования систем восстановления структуры дезоксирибонуклеиновой кислоты и в) окисления жирных кислот. В эксперименте было продемонстрировано обратное развитие диабетической микроангиопатии под влиянием пирувата как метаболита, снижающего ЫАОН/ЫАЕ).
Самым ранним из гистопатологических сдвигов при диабетической ретинопатии является потеря капиллярами сетчатой оболочки своих перицитов. За несколько лет хронической гипергликемии соотношение между эндотелиальными клетками и перицитами ретинальных микрососудов может снизиться от нормального 1: 1 до патологического 1: 10. Кроме того, диабетическую микроангиопатию на уровне сетчатой оболочки глаза характеризуют расширение капилляров, утолщение их базальной мембраны, рост проницаемости и возникновение капиллярных микроаневризм. Все эти патологические изменения капилляров сетчатой оболочки можно связать с утратой нормальных межклеточных взаимодействий между перицитами и эндотелиальными клетками. Известно, что гипергликемия угнетает клеточный рост перицитов. Перициты оказывают на эндотелиальные клетки регуляторные вли
|
|
|