 |
Глава 4, Заметка 5. Назальное pH 5 глава
|
|
|
|
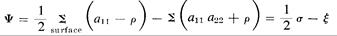
Где теперь o- представляет силы Ван дер Вааля в полости, занимаемой молекулой и ξ; биполярными силами на поверхности полости.
Глава 6, Заметка 3. Разделительная мембрана между водной средой
Возможность получения мембраны с полярными группами на обеих поверхностях, как это установлено для митохондрий, представляет одно из важнейших средств, применяемых в биологии для разделения двух водных растворов. (228) Одним из свойств подобной мембраны является то, что она часто представляет скорее изолирующую преграду, а не функционально активную мембрану. Это следует из факта, согласно которому очень часто подобная мембрана разрывается, когда две водные среды должны перемешаться.
Глава 6, Заметка 4. Разрыв жирных кислот
В рабочей гипотезе биологического разрыва длинноцепочечных молекул для калорического метаболизма мы рассматривали два главных фактора: 1) должна образовываться молекула с четным числом атомов углерода, поскольку окисление Кнупа (Knoop) приводит к полной калорической утилизации только указанных молекул, и 2) что длина углеродной цепи, связанной с карбоксилом, в новой молекуле должна иметь не более 11 углеродных атомов, чтобы могло происходить прямое бета окисление. Чтобы было удовлетворено первое условие, процесс разрыва происходит не между атомами углерода самих двойных связей, поскольку в естественных жирных кислотах двойные связи разделяют части цепей, имеющие обычно нечетное число атомов углерода. Подобный процесс разрыва приведет к образованию молекул, ведущих к дальнейшему неполному окислению по Knoop.
В соответствии с гипотезой, разрыв молекулы происходит у атома углерода, ближе всех находящегося к двойной связи. Благодаря энергетическому влиянию, оказываемому двойной связью, рядом расположенный четный атом углерода оказывается сильно положительным. В качестве первого шага, как было установлено, этот атом углерода присоединяет молекулу кислорода с образованием гидропероксида, как было показано Farmer и сотрудниками для резины (30) и позже для жиров in vitro. (31) При переходе, во второй этап, этой группы гидропероксида в карбоксил, происходит разрыв молекулы на указанном уровне, как показано на РИС 242.
|
|
|

Рис. 242. Окислительный разрыв молекулы жирной кислоты (a) происходит in vivo через появление гидропероксида в атоме углерода по соседству с двойной связью (b). В конце концов, это приводит к образованию карбоксила (c) в этом соседнем атоме углерода, что приводит к формированию цепей с четным числом атомов углерода.
Если четный атом углерода возле двойной связи обращен к терминальной метиловой группе, образуется монокарбоновая кислота. Такой же процесс, происходящий у другого атома углерода, по соседству с двойной связью, обращен к карбоксилу. Образуются молекулы дикарбоновой кислоты. Метаболические изменения in vitro и in vivo показали появление указанных двух групп одноосновных и двухосновных жирных кислот с четным числом атомов углерода. Связываясь с двумя молекулами воды, остающаяся двууглеродная цепь, соединенная двойной связью, образует молекулу уксусной кислоты. Подобные изменения, происходящие в калорических моноэфирах помогли нам объяснить одну из неблагоприятных особенностей, наблюдаемых в составе моноэфирных жирных кислот.
В Заметке 5 мы обсуждали положение двойной связи в главных, естественно встречающихся, моноэфирах, при следовании характерной модели. В молекулах с 16 или меньшим числом атомов углерода двойная связь чаще расположена таким образом, что отделяет группу из 9 атомов углерода с карбоксильного конца, в то время как с 18 и большим числом атомов углерода двойная связь отделяет почти всегда группу из 9 атомов углерода с метилового конца. РИС 243 демонстрирует два характерных примера.
|
|
|

Рис. 243. У двух моноэфиров наблюдается характерное расположение двойной связи. Двойная связь разделяет две группы с четным числом атомов углерода. В миристолеиновой кислоте она отделяет группу из 9 атомов углерода с карбоксилового конца и группу с короткой пятикарбоновой цепью с метилового конца. В hexacosenoic гексакозеновой кислоте (26 C) цепь из 17 атомов углерода отделена с карбоксилового конца и девятикарбоновая - с метилового конца.
Разрыв молекулы, в соответствии с указанным выше процессом, объясняет эту особенность. Цепь из 18 или меньшего числа атомов углерода претерпит биологическое расщепление с образованием двух кислот. Одна из них с 8 атомами углерода, a другая кислота с 8 или меньшим числом атомов углерода, обе подвергнутся кнуповскому окислению. В длинноцепочечной жирной кислоте есть двойная связь, отделяющая девятикарбоновую часть с метилового конца молекулы с образованием восьмикарбоновой цепи в качестве монокислоты, имеющей на другом конце метиловую группу. Другая часть молекулы, с более чем восемью атомами углерода, соответствующая длинной фракции с карбоксилом на конце, приводит к образованию двух кислот. (РИС. 244) Она подвергнется кнуповскому окислению, даже с длинной цепью. В случае двойной кислоты, указанный процесс, связанный с вмешательством карбоксила, может состояться с двух концов, где имеются карбоксилы.
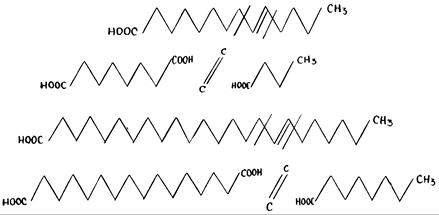
Рис. 244. Благодаря размещению двойной связи в молекулах моноэфиров, разрыв молекул жирных кислот у атомов углерода, расположенных по соседству с двойной связью, приводит к появлению дикарбоновой кислоты в части цепи, имеющей более 10 атомов углерода.
Глава 6, Заметка 5. Положение двойной связи в моноэфирах
Сравнительный анализ главных естественно встречающихся моноэфирных жирных кислот показал наличие необычной конфигурации, благодаря особенному относительному расположению в указанных молекулах двойной связи. РИС 245 демонстрирует расположение указанной двойной связи в главных моноэфирах. (267) Andre показал, что двойная связь чаще расположена таким образом, что она отделяет группу из 9 атомов углерода, оканчивающуюся карбоксилом. Мы смогли показать, что эта группа присутствует в ветви, оканчивающейся карбоксилом, особенно, если цепь имеет 18 атомов углерода, или меньше. В более длинной цепи имеется указанная группа из 9 атомов углерода, но обычно в ветви, оканчивающейся метилом. Важность подобной конфигурации для бета окисления по Knoop обсуждается в предыдущей Заметке.
|
|
|
Такое же разделение групп атомов углерода, содержащих в целом 9 атомов, наблюдается у полиненасыщенных жирных кислот. (РИС. 246)
Глава 6, Заметка 6. Равновесие насыщение—ненасыщение в печени
Положение двойной связи в моноэфирных жирных кислотах

Рис. 245. В главных встречающихся в природе моноэфирах у членов с короткой углеродной цепью двойная связь отделяет группу из 9 атомов углерода с конца молекулы, имеющего карбоксил. У жирных кислот с более чем 18 атомами углерода группа из отделенных 9 атомов углерода расположена со стороны конца, содержащего метиловую группу.
Общее число двойных связей не меняется при одновременных процессах сатурации и десатурации, происходящих в печени. К препарату клеток печени добавляли насыщенные и полиненасыщенные жирные кислоты. Определяли иодное число имеющейся смеси жирных кислот, как обладающих карбоксилом,
так и количество мононенасыщенных членов. После инкубации при температуре 37°C количество моноэфирных членов ряда очень увеличилось. Тем не менее, анализ общего содержания жирных кислот, присутствующих в препарате,

Рис. 246. В полиэфирах группы из 9 атомов углерода, обычно образованные сочетанием двух или трех групп, кратных 3 (3 или 6). Группа из 9 атомов углерода обычно расположена с метилового конца молекулы.
дал то же иодное число, указывая на то, что произошедшие изменения, процессы сатурации и десатурации, друг друга компенсировали, благодаря переносу двойных связей от полиненасыщенных к насыщенным членам.
Глава 6, Заметка 7. Эссенциальные жирные кислоты
Сильно положительный характер углерода карбоксила обусловлен наличием его связи с двумя атомами кислорода. Это вызывает смену полярности с наличием в цепи нечетного числа положительных атомов углерода. С другой стороны, влияние, оказываемое двойной связью в молекуле, соответствует увеличению заряда, присущего соседним атомам углерода. Когда атом углерода расположен в промежуточной позиции между двумя двойными связями, влияние, оказываемое двумя двойными связями, очень увеличивается. Два указанных фактора, положительный характер в виде нечетного атома углерода и промежуточное положение между двумя двойными связями—делает С11 линолевой кислоты особенно сильно положительным атомом углерода, который демонстрирует повышенную способность к образованию связи с отрицательным кислородом. Мы считаем, что этот сильно положительный метиленовый атом углерода представляет состояние, определяющее, имеет ли жирная кислота "эссенциальный" характер.
|
|
|

Рис. 247. Связь между положительным зарядом метиленового атома углерода и характером эссенциальной жирной кислоты. Подобие, существующее между линолевой и линоленовой жирными кислотами, в качестве эссенциальных жирных кислот, может быть объяснено тем, что обе имеют лишь один метиловый атом углерода. Арахидоновая кислота, с такими положительно заряженными атомами углерода, имеет заметно более выраженное указанное свойство.
Это служит дополнительным объяснением особой связи между указанными тремя важными эссенциальными жирными кислотами. Нет различий, с точки зрения активности, в качестве эссенциальной жирной кислоты, между линолевой и линоленовой кислотами, хотя у последней имеется два промежуточных атома углерода, один - уС11 и другой - у С14. Это можно объяснить тем, что второй промежуточный атом углерода, С14, как четный атом углерода, имеет отрицательный электрический характер. С указанной точки зрения, наличия сильно положительного метилового атома углерода, не существует различий между линолевой и линоленовой кислотами. Связь между характером эссенциальной жирной кислоты и промежуточным положительным атомом углерода еще раз подтверждается тем, что арахидоновая кислота, обладающая двумя положительными и одним отрицательным атомами углерода, является также более активной эссенциальной жирной кислотой, чем линолевая и линоленовая кислоты, каждая из которых имеет только один положительный промежуточный атом углерода. (РИС. 247)
Глава 6, Заметка 8D. Присоединение галогенов к конъюгированным двойным связям
То, что присоединение галогенов к конъюгированным двойным связям происходит в два этапа, объясняет сравнительную трудность обратной реакции. Как в случае с бутанедином, ионы галогена сначала присоединяются к внешним атомам углерода конъюгированного образования с появлением двойной связи между центральными атомами углерода. И только во второй этап два других галогена также связываются с указанными атомами углерода, что завершает связывание галогенов со всеми атомами углерода конъюгированного образования. (РИС. 248)
|
|
|

Рис. 248. Присоединение галогенов к конъюгированным двойным связям происходит в два этапа. В первый этап происходит смещение двойной связи в промежуточное положение, что объясняет необратимость указанного процесса.
Глава 6, Заметка 8A. Растворительное функционирование составляющих липиды элементов
При изучении биологической роли липидов мы уяснили важность форм, в которых в организме существуют разные липиды. Указанные формы, вероятно, в большой мере определяют их активность. Липид меняет свою реактивность, когда переходит из свободной формы в такую, которая связана с другими составляющими. Первым этапом в указанном исследовании было аналитическое разделение указанных форм. Таким образом, мы выделили четыре главные формы кислых липидов, а также неомыляемых фракций:
I. Свободные липиды, или те, которые связаны в столь лабильной физической форме, чтобы иметь возможность участвовать непосредственно в разных реакциях, благодаря своим полярным группам.
II. Липиды, связанные in cenapse с другими составляющими, представляющие сравнительно лабильную форму.
III. Липиды, комбинирующиеся, благодаря своим полярным группам, в качестве эфиров или жиров. Эта форма представляет обычно резерв, или неактивную циркулирующую форму, которая может стать активной благодаря гидролизу.
IV. Липиды, столь сильно связанные с другими составляющими, что становятся неразделимыми растворителями, требующими для своего освобождения омыления материала.
Первая форма представляет функциональную форму, вторая – быстро доступный функциональный резерв и третья – резерв. Последняя представляет стабильную комбинированную форму как часть строения самих объектов.
Чтобы выделить их из материала для проведения изучения мы использовали различия в растворимости указанных разных форм липидов с последующим исследованием влияния при нормальных и патологических состояниях. Подобное разделение на группы касается лишь формы, в которой липиды присутствуют в организме, а не их химического состава.
Несмотря на лишь относительную степень точности в некоторых выделенных таким образом образцах, различия между ними столь заметны и постоянны, что указанный метод следует рассматривать в качестве интересного и надежного источника информации. Поэтому, в течение нескольких лет, мы применяем указанный метод выделения для получения тысяч образцов. При использовании указанной выше методики, разработанной нами, анализируемый материал, ткани, органы, целые организмы или лишь биологические продукты, с необходимой точностью разделяются в блендере. Затем они экстрагируются несколько раз эфиром в режиме встряхивания или в аппарате Soxhiet. При указанных условиях эфир удаляет липиды, присутствующие в форме свободных липидов или нейтральных жиров. Это представляет смесь фракций I + II. Остаток затем вновь экстрагируется, на этот раз смесью 10% этилового спирта, который разрывает связь и выделяет липиды, ранее связанные между собой. В результате получают фракцию III. Остаток подвергают омылению 10% КОН и экстрагируется эфиром. Теперь это уже фракция IV US или неомыляемые липиды фракции IV. После подкисления винной кислотой, образуется новый экстракт, представляющий фракцию IV LA или кислотные липиды этой фракции.
Эфир фракции I + II дистиллируется и остаток, обработанный 85-90% спиртом, селективно растворяющий свободные липиды в качестве фракции I, оставляет часть, образованную нейтральными жирами в виде фракции II.
Фракции I, II и III затем подвергаются омылению раздельно. Неомыляемые фракции экстрагируются эфиром, давая соответственно фракции
I US, II US и III US. После подкисления винной кислотой, с помощью эфира получают другие экстракты, представляющие соответственно фракции I LA,
II LA и III LA. Каждая из указанных фракций промывается дистиллированной водой, высушивается безводным сульфатом натрия. После того как эфир дистиллируется, эти фракции взвешивают.
Таким образом, для каждого материала мы получили четыре разные фракции для неомыляемой части, которую мы называем фракциями US, и четыре – для омыляемой, называемой фракциями LA. Они соответствуют:
I, свободным липидам; II, липидам, присутствующим в качестве эфиров или жиров; III, липидам, связанным между собой; IV, липидам, связанным в комбинациях, которые высвобождаются только путем омыления. В следующих случаях мы избирали разные материалы для иллюстрации информации, полученной указанным методом.
РИС. 249 представляет результаты, полученные у нормальных крыс, у крыс при ненормальных состояниях, а также при опухолях. Все они экспрессировались в виде 8 липидных фракций.
Для облегчения проведения сравнения между нормальными и патологическими состояниями, мы, в этом примере, выбрали крыс весом 180 - 200 г, всех, за единственным исключением, самцов (случай b). Полученные данные, таким образом, сравнили с таковыми, полученными для случая (a) который соответствует нормальному самцу-крысе, умерщвленному эфиром. Анализ липокислотных фракций в этом случае показывает фракцию (IV) в количестве 3.5 мг/г веса животного, фракцию III в связи – в количестве 0.2 мг/г, II, соответствующую жирам – в количестве 1.2 мг/г и фракцию I, в виде свободных липидов, - в количестве 8.1 мг/г веса животного. А для неомыляемой фракции, присоединенная часть IV – в количестве 0.8 мг/г веса животного, III в связи – в количестве 2 мг, II в виде жиров – в количестве 0.8 мг, и свободная часть I – в количестве 7 мг/г веса животного.

Рис. 249. Разделение разных липокислот и неомыляемых фракций у разных животных и при разных опухолях растворением. Величины выражены в мг/г веса тела животного. Они демонстрируют большие колебания, особенно это касается свободных липидов. (Верхняя фракция)
Для крыс-самок (b), в общем, характерны более низкие цифры для кислотных
фракций и более высокие – для каждой фракции неомыляемой части. Интересно отметить, что связанная часть (IV) кислотных липидов ниже, чем у любого самца, факт, подтвержденный другими анализами. Увеличение неомыляемой части относится особенно cenapse, жиров и фракций свободных липидов. Указанные различия соответствуют данным, касающимся связи между липидами у самцов и самок, как отмечено в дискуссии в Главе 6.
Интересно отметить изменения у голодавших животных, как это продемонстрировано в случае (с), где наблюдалось заметное уменьшение неомыляемых фракций, но с увеличением кислотной части, особенно в свободной фракции (которая достигает величины 13 мг/l г). Подобные изменения наблюдаются при остром шоке (d), вызванном внутривенной инъекцией обогащенной культуры Esch. coli в бульоне. Хотя смерть происходила менее чем за 40 минут, наблюдалось заметное увеличение свободных жирных кислот с соответствующим уменьшением неомыляемых фракций. Отклонение от нормы в этом же направлении отмечено еще в большей степени у животных, находящихся в состоянии шока (индуцированного 700 падениями в барабане Collip-Noble), (e). У умирающего животного отмечено заметное увеличение содержания свободных жирных кислот (37 мг/l г) с явным уменьшением неомыляемых фракций. Были также обнаружены случаи с более чем 70 мг/l г свободных жирных кислот. Летальная доза облучения (1500 р) (f), и тепловых ожогов (g), давали идентичные изменения.
Интерес также представляло влияние, оказываемое внутрибрюшинной инъекцией глицерина и холина с впечатляющим увеличением всех фракций кислотных и неомыляемых липидов, а также тех, что находятся в связи и жировых фракций (h). Мы выбрали пример (i) другого животного, подвергшегося тому же лечению, для демонстрации степени соответствия информации, предоставленной этим методом.
Было показано, что почти при всех условиях, количество фракции IV, полученной путем омыления, меняется очень мало. Количество, присутствующее в связи и нейтральные жиры обнаруживают больше вариаций. Эти свободные липиды фракции I варьируют от одного случая к другому. Их, таким образом, можно связать более непосредственно с патогенетическим вмешательством липидов.
Еще один вывод можно сделать из анализа указанных результатов. Высокое количество свободных липидов, часто получаемое при измененных условиях, нельзя расценивать только как результат освобождения указанных липидов из предсуществующего резерва в качестве нейтральных жиров или из более лабильной связанной формы, поскольку общее количество обнаруженных свободных липидов намного больше, чем сумма этих форм. Появление новых липидов, путем синтеза, становится при этих условиях явным.
Примером (j) может служить анализ животного с двенадцатидневной опухолью Walker. Сравнение с нормальными животными контрольной группы демонстрирует уменьшение кислотолипидной части с увеличением по всем четырем фракциям. Изучение самой опухоли (k) показывает еще большие различия. Фиксированная фракция меньше, чем полученная из тел животных, взятых целиком, в то время как связанная часть очень увеличивается. Свободная липокислотная фракция почти равна нулю. Доля неомыляемых фракций, находящиеся в связи, и особенно тех, что соответствуют свободным липидам, очень увеличиваются. В некротически измененной опухоли все четыре липокислоты и неомыляемые фракции увеличены. Последние, однако, в большей степени. Хотя количество связей высоко, увеличение наиболее явно в свободной фракции. Случай (m) одного животного, леченного sulfur mustard, примененной на кожу, оказался особенно интересным. У животного, умершего на четырнадцатый день, почти не оставалось неомыляемых фракций (меньше 1 мг/l г).
Указанный метод мы широко использовали многие годы, несмотря на одно его ограничение - несовершенное отделение нейтральных жиров от свободных липидов.
Большая согласованность всех указанных вариаций, однако, практически перевесила такой фактор, как невозможность должного разделения указанных свободных фракций липидов.
Глава 6, Заметка 8B. Спектральный анализ
В сотрудничестве с Carlos Huesca-Mejia и Priscilla Teitelbaum мы изучили несколько тысяч проб препаратов липидов путем спектрального анализа, в ультрафиолете и первой порции видимого света, a также, реже - в инфракрасном свете, используя спектрофотометр Beckman. Здесь мы приведем лишь некоторые главные выводы, к которым мы пришли.
1) Учитывая методики химической изомеризации, мы смогли показать важность температуры, которая применялась при обработке смеси жирных кислот. Конъюгация in vitro, обычно происходящая с этиленгликолем или глицерином в качестве растворителей, как было установлено, приводит к образованию препаратов со слишком малыми количествами тетра-, пента- и гексаеновых членов. Сравнительно быстрое исчезновение конъюгированных образований с 4, 5 и 6 двойными связями, как было показано, было индуцировано высокой использованной температурой. Это побудило нас использовать новый метод конъюгации, при более низких температурах. Используя этиловый спирт в качестве растворителя, получены препараты с высокими конъюгированными образованиями.
2) Мы использовали спектральный анализ для количественного определения не только ди-, три- и тетраенов, как выполняют обычно, но также и для пентаенов и гексаенов. С этой целью мы определяли коэффициент затухания, соответствующий указанным пентаеновым и гексаеновым образованиям. Это оказалось возможным благодаря выделению соответствующих пентаеновых и гексаеновых конъюгированных членов с помощью подходящих растворителей.
3) Мы изучили разные материалы и, особенно, разные органы для того, чтобы провести корреляцию их обогащенности в разных жирных кислотах с их биологической активностью, используя спектральный анализ конъюгированных in-vitro жирных кислот, как приведено выше.
4) Идентично, мы попытались провести корреляцию существования характерных пиков в кривой спектрального анализа неомыляемых фракций органов с их биологической активностью.
5) Мы использовали спектральный анализ для изучения эффектов разных агентов, таких как хлор, серная кислота или кислород, в отношении жирных кислот.
6) Мы показали, что минимальные изменения индуцированы в неполярных группах конъюгированных жирных кислот путем изменения их полярной группы с карбоксила на первичный спирт благодаря обработке литиево-алюминиевым гидридом.
7) Мы изучили влияние, оказываемое конъюгированными жирными кислотами на канцерогены. Его можно частично выявить по охлаждающему действию, индуцированному в отношении флуоресценции агентов, указанных последними.
8) Мы предприняли широкое исследование влияния, оказываемого облучением в отношении жирных кислот in-vitro и in-vivo. Это влияние характеризовалось появлением конъюгированных триенов и представлено в Главе "Облучение" и в других Заметках.
Глава 6, Заметка 8C. Фракцонирование жирных кислот испарением
В группе экспериментов для изучения жирных кислот мы применили газовую хроматографию. Главной целью считали исследование ценности информации, предоставляемой указанным методом, о наличии конъюгированных жирных кислот. Это исследование выполнено в сотрудничестве с Ivan Bier и Winston Dindial, которые готовили пробы.
Были получены метиловые эфиры элеостеариновой кислоты, линолевая кислота и ее конъюгированные изомеры; из жирных кислот льняного масла и конъюгированный препарат; из жирных кислот жира печени трески и конъюгированные препараты; а также пробы жирных кислот, полученные от животных и из тканей при нормальных и ненормальных состояниях. Путем парового фракционирования мы анализировали указанные разные препараты в качестве таковых, препараты, полученные путем конденсации на холодных пальцах во время дистилляции в вакууме при разных температурах, a также различные фракции, полученные путем дистилляции в вакууме. Для всех указанных тестов мы использовали паровой фракционизатор Perkin-Elmer с колонкой из сукциниловых полимеров, нагретых до 235°C. При указанных условиях между соответствующими конъюгированными и неконъюгированными веществами различий не выявлено. РИС. 250 и 251 демонстрируют примеры таких анализов препарата жирных кислот жира печени трески и препарата, полученного после обработки гидроокисью калия в бутиловом спирте.
РИС. 252 демонстрирует спектральный анализ продукта, указанного последним. При условиях проведенного анализа метод газовой хроматографии не позволяет провести идентификацию присутствующих конъюгированных изомеров. В этом состоит причина, почему указанный аналитический метод не может указать на присутствие подобных членов в материалах, полученных в ненормальных условиях. Конъюгированные изомеры могут быть идентифицированы другими методами—такими как спектральный анализ и, особенно, щавелевокислотный показатель—после окислительного расщепления.
Сейчас мы пытаемся получить колонки, позволяющие работать при много больших температурах, что позволит нам идентифицировать указанные конъюгированные жирные кислоты. В связи с тем, что для анализа требуется лишь минимальное количество материала, а достигаемая степень точности при этом достаточна, приспособление указанного метода для идентификации конъюгированных членов будет представлять особую ценность.
Глава 6, Заметка 9. Близнецовое образование
Нечетное число атомов углерода в циклической молекуле представляет одно из состояний, которое всегда приводит к появлению близнецового образования, поскольку противопоставление между положительным и отрицательным знаками придает одинаковый электрический заряд двум соседним атомам углерода. (РИС. 254) Корреляция положительного и отрицательного зарядов расположенных рядом атомов углерода, а также то, что молекулы уксусной кислоты использовались при синтезе молекулы, представляет дополнительный фактор индуцирования близнецового образования, даже в циклах с четным числом атомов углерода.

Рис. 250. Газохроматографический анализ пробы жирных кислот жира печени трески, демонстрирующий некоторые разнообразные составляющие.
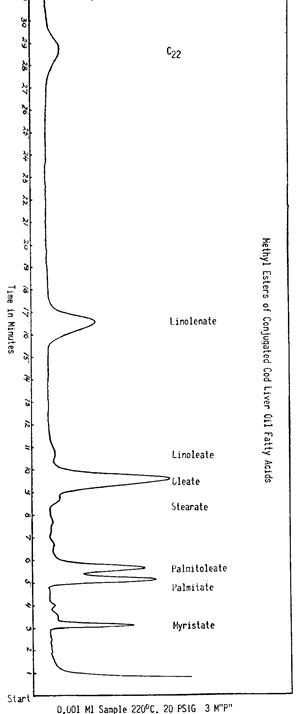
Рис. 251. Газохроматографический анализ пробы жирных кислот жира печени трески после химической конъюгации. Не видно никаких различий между кривой Рисунка 250 и этой кривой, что указывает, учитывая меющиеся условия проведения анализа, на то, что конъюгированные члены не выявлены.

Рис. 252. Спектральный анализ пробы для газовой хроматографии, демонстрируемый на Рисунке 251, указывает на присутствие ди-, три-, тетра-, пента- и гексаеновых конъюгированных членов.
|
|
Рис. 254. Близнецовое образование появляется в циклопентане в результате противоположного знака соседствующих атомов углерода.
Глава 6, Заметка Связь арахидоновая кислота —стерин
Связь между арахидоновой кислотой и стеринами, которые все присутствуют в надпочечниках, прослеживалась по изменениям, происходившим в количестве указанных веществ при патологических процессах. Кролям выполняли внутривенные инъекции суспензии микробов медленно, вплоть до появления симптомов глубокого острого шока. Животные немедленно забивались путем кровопускания, а надпочечники и их кровь анализировались. Количество полиненасыщенных жирных кислот надпочечников заметно уменьшалось, а у некоторых животных они почти исчезали из указанных органов. В это же время количество тех же жирных кислот в циркулирующей крови заметно возрастало. Количество неомыляемых фракций и стеринов в надпочечниках не изменялось, по сравнению с животными контрольной группы. Казалось, что жирные кислоты перешли из надпочечников в общий кровоток в качестве первого ответа на вредоносное вмешательство.
|
|
|



