 |
Глава 4, Заметка 5. Назальное pH 6 глава
|
|
|
|
Глава 6, Заметка 11. Стероиды, производные от арахидоновой кислоты
Изучение связи между стероидами и определенными жирными кислотами привело нас к гипотезе, в соответствии с которой некоторые стероиды являются сами производными жирных кислот. Хотя синтез холестерина из скалена (230) является весьма вероятным, он не представляет единственный источник для всех стероидов. Члены с цепью содержащей два углеродных атома, происходят от других веществ. Здесь мы приводим указанную гипотезу потому, что она также представляет пример иной важной роли, которую играют двойные связи, участвующие в процессе циклизации в организме.
В соответствии с предложенной нами гипотезой, полиненасыщенные жирные кислоты приводят к образованнию аллопрегнана, родительского стероида с двууглеродной боковой цепью.
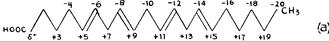
РИС. 255 показывает разные фазы подобной трансформации, начиная с арахидоновой кислоты. Присутствие карбоксила и четырех двойных связей в молекуле арахидоновой кислоты приводит в некоторых атомах углерода к образованию особенно сильного энергетического заряда. Существует ряд сильно заряженных атомов углерода:
1) C1, благодаря своей связи с = 0 и — OH; 2) С2 и С3, благодаря процессу индукции, поскольку они находятся рядом с карбоксилом; и 3) С5 и С6 С8 и С9, С12 и С13, и С16 и С17, соответственно связанными двойными связями.
Благодаря взаимной индукции, все нечетные атомы углерода имеют положительный знак, а с четным - отрицательный, как следует из РИС π 255a. Из-за высокой гибкости алифатической цепи и присутствия атомов углерода с сильно положительным и отрицательным характером в одной и той же молекуле, наблюдается притяжение между сильно заряженными атомами углерода, имеющими противоположный знак в одной и той же молекуле. Это приводит, сначала, к сгибанию цепи, так что сильно заряженные атомы углерода с противоположными знаками будут обращены друг к другу. (РИС. 255 b)
|
|
|
Затем, в качестве второго шага, поскольку указанные атомы углерода связаны двойными связями, соответствующие π электроны двойных связей послужат образованию новой связи между обращенными друг к другу атомами углерода и, таким образом, закрывают циклы. Это будет происходить без потери или приобретения электронов. Эти три двойные связи между С5 и С6, С11 и С12, и С14 и С15 будут служить для закрытия указанных трех циклов. (РИС. 255 c) Двойная связь между С8 и С9 будет способствовать высокой реактогенности С9. Как мы обнаружили, С9 арахидоновой кислоты соответствует С3 циклопентанофенантрена, что объясняет, почему этот атом углерода обладает высокоположительным характером, имея фиксированный кислород. Атом углерода карбоксила может быть использован, как для образования метиловой группы у С13 или, более правдоподобно, может утрачиваться в процессе декарбоксилирования, который благодаря самому себе, в указанном случае, будет индуцировать связь между С2 и С18 молекулы арахидоновой кислоты. Благодаря вмешательству сильного энергетического центра, закроется пентановый цикл, с приобретением двух одинаково заряженных атомов углерода. (РИС. 255 d) Эти два метила, соответствующие С13 и С19 молекул стероидов, будут результатом дальнейшего процесса метилирования после образования полициклической молекулы. С2 и С6 арахидоновой кислоты будут особенно склонны иметь на себе фиксированной метиловую группу благодаря их электронному смещению, вследствие наличия новой связи.
|
|
|
|
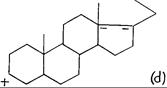
Рис. 255. Гипотеза синтеза радикала аллопрегнана из арахидоновой кислоты. РИС. (a) демонстрирует относительное расположение двойных связей в молекуле арахидоновой кислоты. РИС. (b) демонстрирует, как молекула сгибается, благодаря притяжению между противоположно заряженными С2 и С15, С5 и С14, и С6 и С11. На РИС. (c) циклы закрываются с участием электронов, предоставляемых двойными связями, (d) Закрытие циклопентана происходит с появлением близнецового образования. Электроны двойной связи между С8 и С9 становятся доступными у С6 (С5 аллопрегнана) для реализации связи с кислородом у указанного атома углерода.
|
|
|
Указанная гипотеза объясняет биологическую связь между арахидоновой кислотой и кортикоидами. Надпочечники особенно богаты обоими. Синтез, происходящий при минимальной изменении имеющихся в наличии электронов и атомов, объясняет две наиважнейшие характеристики указанных кортикоидов, высокую энергетическую величину С3 и циклопентана с его близнецовым образованием. Предварительные эксперименты показали, что в препарате ткани надпочечников, арахидоновая кислота может преобразовываться в кортикоиды под влиянием адренокортикотропного гормона гипофиза (ACTH).
Глава 6, Заметка 12. Образование пар стероидами
Благодаря взаимному влиянию, присутствующие в неполярных частях двух молекул, энергетические центры, теряют большую часть своей активности. Стериновая ассоциация возможна, если указанные две противоположные молекулы, при условии их предварительной связи благодаря комбинированию своих полярных групп, также сцепляются между собой неполярными группами через противостоящие энергетические центры или образования, присутствующие в двух молекулах. Подобным образом стериновая ассоциация завершает частичную взаимную нейтрализацию молекул, полученных вследствие комбинирования полярных групп. Связь между полярными группами, удерживающая эти две молекулы в определенном положении одна против другой, таким образом, составляет важное условие стериновой ассоциации.
Глава 6, Заметка 13. Лютеоидная функция
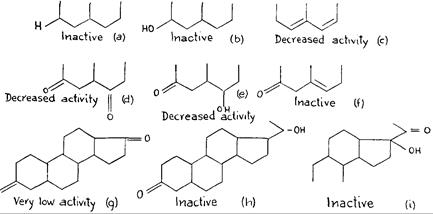
Оказалось, что лютеоидная модель может быть связана со специфическим аспектом энергетической картины этого вещества – присутствием двух сравнительно сильных нуклеофильных центров в характерных противоположных положениях, один – у С3 и другой - у С20, как в прогестероне. В действительности, любое изменение энергетической картины этого стероида будет уменьшать лютеоидные свойства. Связь лютеоидного свойства с нуклеофильностью у С3 обнаруживается легко. Недостаток нуклеофильного центра у атома углерода 3, как в прегнане 20, (РИС. 256 a)приводит к образованию неактивного вещества с полным изменением энергетической картины. Таким образом, единственный нуклеофильный центр оказывается неспособным для обеспечения лютеоидного качества.
|
|
|
Вещество становится неактивным, если вместо нуклеофильного центра, обеспечиваемого = 0 у атома углерода 3, присутствует электрофильный центр, как в прегнановом 20, так что энергетическая картина уже не соответствует лютеоидной модели. (РИС. 256 b)
Любое изменение нуклеофильности центра С = 0 у С3 уменьшит лютеоидные свойства вещества. Присутствие второй двойной связи между атомами углерода 6 и 7, как в 4, 6 прегнандиендионе 3-20, (РИС. 256с) несмотря на то, что он увеличивает величину нуклеофильности карбонила у атома углерода 3, изменит энергетическую модель и, таким образом, также уменьшит лютеоидный характер. С другой стороны, уменьшение нуклеофилии этого центра приводит, благодаря идентичному влиянию на энергетическую модель, к уменьшению лютеоидного свойства. В случае прегнантриона 3-6-20, (РИС. 256 d) недостаток двойной связи в цикле и при взаимной индукция, реализуемой параллельными двойными связями двух карбонилов, уменьшается нуклеофилия центра С3, а в месте с этим, и лютеоидные свойства. Это также относится к Δ 5 прегнандиону-З-20-ol 6, (РИС. 256 e), в котором присутствие гидроксила у С6 также как и непараллельной связи между С5 и С6, уменьшает ионный характер С = 0 у атома углерода 3. У Δ 5 прегнандиона 3-20, (РИС. 256]) в котором изменяется только двойная связь между атомами углерода 5 и 6, будучи противоположной таковой карбонила у атома углерода 3, ионная величина С = 0 у С3 уменьшается, вместо того, чтобы увеличиваться. При этом лютеоидное свойство, вероятно, полностью исчезает.
Вторым условием для лютеоидного свойства является нуклеофильный центр у С20. Любое изменение его характера или величины повлияет на лютеоидное свойство вещества. Андростандион, (РИС. 256 g) имеет нуклеофильный центр у атома углерода 3, как это наблюдается у прогестерона, однако с = 0 непосредственно связанная с атомом углерода 17, и не имеющая никакой боковой цепи, представляет энергетическую картину с двумя нуклеофильными центрами. Однако, нуклеофильный центр = 0, связанный непосредственно с атомом углерода 17, придает этой части молекулы иной характер. Вещество, таким образом, обладает лишь некоторыми лютеоидными свойствами. Δ 4 прегнан-один 3-ol-20, (РИС. 256 h) в котором карбонил у атома углерода 20 заменен гидроксилом, является, с другой стороны, неактивным, поскольку вещество имеет картину, отличающуюся от таковой у динуклеофильной модели. Также неактивен Δ 5 прегнондион-3-20-ol 17, (РИС. 256 i) в котором присутствие гидроксила у атома углерода 17 изменяет энергетическую картину в этой оконечности стероида.
|
|
|
|
|
|
|
|
|
Рис. 256. Любое изменение энергетических характеристик центров, которое, как оказалось, связано с лютеоидной активностью, приводит к уменьшению или исчезновению указанной активности.
Присутствие двойной связи между атомами углерода 11 и 12 (РИС. 25 j) уменьшит лютеоидную активность благодаря индукции и полевому влиянию между непараллельными двойными связями и и уменьшению ионного характера С20, связанного с кислородом. Влияние, оказываемое гидроксилом по соседству с атомом углерода 17, представляет особый интерес. Благодаря индуктивному эффекту OH, присоединенный к атому углерода 12 (РИС. 256 k), меняет ионную величину С = О, присоединенной к атому углерода 20 и, таким образом, уменьшает лютеоидную активность. Гидроксил, связанный с атомом углерода 11, обладает значительно более интенсивным эффектом, меняя ионный характер связей между ним = 0 и, таким образом, инактивируя лютеоидное свойство. (РИС. 2561)
Для большинства стероидов с центрами = 0 метаболизм приводит к изменению этого центра в гидроксиле. Продукт изменения С = 0 в С = ОН, представляющий форму, в которой указанный гормон выделяется, является неактивным. Прегнандиол 3-20, (РИС. 256 m) со структурой, слабо напоминающей модель, необходимую для лютеоидной активности, не обладает лютеоидными свойствами.
Глава 6, Заметка 14. Энергетический центр в стероидах
В энергетическом аспекте, имеется сильно положительный заряд углеродного атома 20 самой цепи, как следствие присутствия в указанной ситуации нуклеофильного центра. Затем появляется сильно отрицательный заряд для атома углерода 21. Таким образом, ионное значение связи, соединяющей OH с С21, увеличивается. С увеличением реактогенности указанного радикала, электрофильный характер этого центра OH становится еще сильнее. Относительная активность противоположных энергетических центров, расположенных неподалеку друг от друга, индуктивно увеличивается.
|
|
|
Глава 6, Заметка 15. Связь между кортикоидами
Кортикоиды можно рассматривать в аспекте изменений, происходящих в общем метаболизме организма. В эволюции указанных стероидов процесс окисления будет участвовать в главных энергетических центрах. К углеводам первым будет присоединяться гидроксил, а затем и кислород. Инверсионный процесс уменьшения будет происходить в качестве метаболического процесса, при том, что OH, будучи обычной формой, через которую элиминируются стероиды, часто связывается с глюкуроновой кислотой. Подобный процесс окисления будет происходить у С11.
Присоединение OH к дезоксикортикостерону (Δ 4 прегнан-21-ol-3:20-диону), приведет к появлению кортикостерона (Δ 4-прегнан-11:21-диол-3:20-дион). Дальнейшее окисление изменит указанныйOH на О, приводя к образованию дегидрокортикостерона (Δ прегнан-21-ol-3:11:20-трион). Все они являются минералокортикоидными соединениями.
С дальнейшим изменением, на этот раз у С17, где присоединится гидроксил, при этом все три соединения—дезоксикортикостерон, кортикостерон и дегидрокортикостерон—проявляют неоглюкогенные свойства. Они представляют производные 17 гидрокси в виде 17 гидроксикортикостерон (Δ 4-прегнан-17-9 (бета):21-диол-3:20-дион); 17 гидроксикортикостерон (Δ 4-прегнан-11 (бета):17 (бета):21-триол-3:20-дион), или соединение F; и 17 гидрокси-11 дегидрокортикостерон (Δ 4-прегнан-17:21-диол-3:11:20-трион-one), или cоединение E, или кортизон.
То, что присутствие гидроксила у С17 очень меняет свойства всей группы, способствует участию энергетического образования, частью которого является С17, в специфической активности указанных веществ.
Анализ состава кортикоидов подтвердил то, что они имеют характер липоидов – будучи полярно-неполярными веществами, в них превалирует неполярная группа. Было установлено, что изучаемые минералокортикоиды и неоглюкогенные кортикоиды индуцируют изменение в направлении низких значений величины pH струпа раны второго дня, что свидетельствует в пользу тенденции к индукции дисбаланса типа A.
Глава 6, Заметка 16. Гипотеза шаблона
Рисунок 257 демонстрирует образование шаблона в кортизоне, который распространяется от С11 до С21. Каждый из указанных шести атомов углерода будет привлекать атом углерода из радикала, находящегося спереди от него. Энергетический характер каждого из шести атомов углерода шаблона будет определять электрофильный и нуклеофильный характер присоединенного подобным образом атома углерода. Указанное присоединение легко индуцируется, когда эти группы образуют уксусные радикалы, имеющие электрофильный и нуклеофильный атомы углерода. Более того, величина атомов углерода шаблона также будет определять, какой полярный радикал будет связан с соответствующим атомом углерода, удерживаемым впереди него. Обычно, атом углерода, удерживаемый впереди от атома углерода шаблона, будет иметь противоположный по знаку заряд. Удерживаемая на месте полярная группа, связанная с атомом углерода, будет иметь знак, противоположный знаку полярной группы, связанной с углеродным атомом шаблона. Когда первая полярная группа занимает положение параллельное таковой полярной группы шаблона, обе будут иметь одинаковый знак электрического заряда.
Следует отметить, что С21 шаблона имеет OH, при этом группа нуклеофильна. Это способствует тому, что атом углерода, удерживаемый впереди, предпочтительно связывает кислород, образуя нуклеофильный центр. С20 шаблона, соответствующий карбонилу, представляет нуклеофильный центр. Он обладает сильной реактогенностью, имея кислород, связанный двойной связью. Позитивность С20 также весьма увеличивается благодаря ее связи с двумя сильно отрицательными атомами углерода, С20 и С17, каждый из которых, соответственно, связан с гидроксилом. Благодаря указанной высокой позитивности, С20 будет индуцировать сильную реактогенность у атома углерода, удерживаемого впереди него. Этого хватит, чтобы сильно связать радикал противоположного кислороду знака и более сильного чем гидроксил; то есть - аминогруппу.
Особое положение OH, связанного с С17, по отношению к шаблону, будет индуцировать связывание атома углерода, удерживаемого впереди него, с другим гидроксилом. То же касается атома углерода 13. Это результат относительно сильной молекулярной реактогенности указанных двух атомов углерода вследствие наличия близнецового образования, которое они

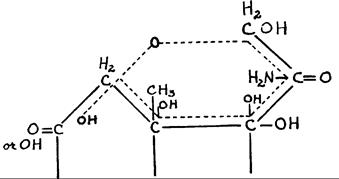
РИС. 257. Гипотетический вид шаблонного образования между 11 и 12 атомами углерода молекулы кортикоида. Группы, удерживаемые в образовании впереди разных атомов углерода, служат для синтеза новых веществ. В этом, представленном выше примере, шаблон молекулы кортизона приведет к появлению молекулы глюкозамина.
образуют. Метил, связанный с С13, будет определять стериновое положение гидроксила, связанного с соответствующим атомом углерода, удерживаемого впереди указанного атома углерода.
Воздействие атома углерода 12 разнится. Оно очень зависит от близнецового образования и обладает противоположным энергетическим характером по отношению к атомам углерода 13 и 17. Соответственно, оно будет способствовать связыванию атома углерода, удерживаемого впереди С21. По своему расположению, атом углерода, находящийся впереди от С12, также будет ближайшим к атому углерода, удерживаемому впереди от С21, который также был индуцирован для связывания с кислородом, как это было показано выше. Это сделает возможным для такого же кислорода вступление в связь двумя атомами углерода, удерживаемыми впереди С12 и С21, с закрытием, таким образом, гексагонического цикла. Радикал, связанный с углеродным атомом 11, приведет к тому, что углеродный атом, находящийся впереди него, свяжется с противоположным радикалом. В случаях, в которых С11 обладает кислородом, связанным с ним, как в кортизоне, атом углерода, удерживаемый впереди него, свяжет гидроксил. Присутствие гидроксила, связанного с С11, как в гидрокортизоне, приведет к связыванию карбоксила с соответствующим атомом углерода, удерживаемым впереди него. Таким образом, было установлено, что синтез, индуцированный шаблонным образованием кортизона, приведет к образованию молекулы глюкозамина, в то время как у гидрокортизона синтезированная молекула будет соответствовать глюкозаминовой кислоте.
Глава 6, Заметка 17. Показатель адреналовой защиты
E. F. Taskier в сотрудничестве с автором, изучил участие надпочечников в защите от разных жирных кислот. (231)
Известна важная роль надпочечников в защите организма от вредоносных агентов, поскольку нормальное животное отличается большей сопротивляемостью по отношению к токсическим эффектам, чем подвергшееся адреналэктомии. Систематическое изучение участия надпочечников показало, что оно происходит несколько особенным образом.
Применен следующий метод исследования: инбредные вистаровские крысы одного пола, весящие приблизительно 150 г, подверглись адреналэктомии. Хирургическая методика была тщательно стандартизирована, ее продолжительность составила менее двух минут, она наносила животному минимальную травму. Это оказалось возможным, благодаря использованию щипцов для фиксации, разработанных Noyes, применяемых в глазной хирургии и позволяющих изымать надпочечник, не повреждая окружающие ткани. В качестве контрольной группы использовались животные того же пола и веса, подвергшиеся операции после голодания. На третий день после операции внутриперитонеально вводили агент, который подлежал тестированию. К этому времени организм выздоровел от непосредственных травматических воздействий, связанных с проведенной операцией, уже в отсутствии симптомов адреналового дефицита. Только смерти, случившиеся в срок до 48 часов после вмешательства, считались вызванными благодаря непосредственному токсическому эффекту указанного вещества. Смерти, случившиеся по прошествии 5 суток после адреналэктомии, могли быть уже отнесены к эффектам самой адреналовой недостаточности, и, по указанной причине, не были включены в эксперимент.
Минимально летальная доза определялась путем применения прогрессивно возрастающих доз. Это было проделано отдельно для адреналэктомированных животных и животных контрольной группы. В этом состояло различие в токсичности между контрольными и адреналэктомированными животными, что принималось во внимание в первую очередь, а не токсичность самого вещества.
Вычислялось соотношение минимальных летальных доз двух групп крыс, контрольных и адреналэктомированных. Это обеспечивало числовое представление о степени выраженности влияния надпочечников и было названо «показатель адреналовой защиты», или ПАЗ. Мы использовали указанный показатель, MLD Контрольные MLD Адреналэктомированные, как степень относительного участия надпочечников в защите организма от разных веществ. Низкое значение показателя указывает на общий неспецифический ответ; более высокий показатель свидетельствует о более существенном вмешательстве.
Мы вычислили ПАЗ для разных групп жирных кислот. Среди них были гомологические ряды насыщенных, ненасыщенных, альфа-OH и конъюгированных жирных кислот.В этом исследовании было занято более 900 крыс.
Для насыщенных жирных кислот мы установили:
| ЖИРНАЯ КИСЛОТА | ПАЗ |
| Капроновая.......... | 2.5 |
| Каприловая | 5 |
| Каприновая | 5 |
| Лауриновая кислота........... | 1.5 |
| Миристиновая кислота | 2 |
| Пальмитиновая кислота | 12 |
| Стеариновая кислота | 6 |
Мы сделали вывод о том, что защитные возможности организма в отношении указанных жирных кислот оказалась лишь чуть более эффективными у мнимо-оперированных, чем у адреналэктомированных, животных. Как было установлено, надпочечники не были особенно активны при защите от указанных веществ.
Что касается ненасыщенных жирных кислот, мы получили следующие данные:
| ЖИРНАЯ КИСЛОТА | П.А.З. |
| Олеиновая | 6 |
| Ленолевая | 9 |
| Леноленовая | 5 |
Приведенные данные свидетельствуют о более активном противодействии надпочечников указанным жирным кислотам.
Также были получены следующие результаты исследования, что касается насыщенных альфа-OH жирных кислот:
| ЖИРНАЯ КИСЛОТА | ПАЗ |
| α-ОН-Капроновая | 4.5 |
| α-ОН Каприловая | 4 |
| α-ОН Каприновая | 3 |
| α-ОН Лауриновая кислота | 20 |
| α-ОН Миристиновая кислота | 9 |
| α-ОН Пальмитиновая кислота | 3 |
| α -OH Стеариновая | 50 |
Мы выбрали эти ряды веществ, поскольку Camien и Dunn, а также другие исследователи, показали важность указанных жирных кислот для роста бактерий, а также присутствие альфа-OH лауриновой и альфа-OH миристиновой кислот в качестве части липидо-полисахаридной фракции бактерий.
Также особый интерес у нас вызвала величина ПАЗ молекул жирных кислот, имеющих конъюгированные двойные связи. В качестве конъюгированного диена мы назначили конъюгированную линолевую кислоту. Величина ПАЗ указанного вещества оказалось идентичной таковой его неконъюгированного изомера и составила 5. В случае конъюгированного триена, мы использовали элеостеариновую кислоту, полученную из тунгового масла. Результаты оказались поразительными. Величина ПАЗ составила 120.
То есть ПАЗ указанной кислоты оказался в 24 раза больше чем показатель ее неконъюгированного изомера.
Указанные данные свидетельствуют о специфичности реакции адреналового защитного механизма. При этом величина ПАЗ, составляющая 3 и больше, может интерпретироваться как общее неспецифическое влияние надпочечников в отношении жирных кислот, в то время как большие значения показателя указывают на их большую, возможно, специфическую активность. В случаях альфа-OH лауриновой и альфа-OH стеариновой кислот высокие значения ПАЗ могут быть интерпретированы как свидетельство того, что указанные жирные кислоты, как было установлено, представляют составную часть бактерий.
Интенсивная защитная реакция, в пользу которой свидетельствует большая величина ПАЗ для элеостеариновой кислоты, связана с появлением конъюгированных триенов в процессе течения определенных патологических состояний, особенно травм. Постоянное повышение, особенно конъюгированных триенов, у адреналэктомированных животных, свидетельствует о том, что указанные жирные кислоты появляются в организме, однако в нормальных условиях разрушаются. Однако у адреналэктомированных животных они накапливаются и могут послужить причиной смерти при достижении ими определенной критической концентрации. Вполне возможно, что при дополнительном назначении указанных конъюгированных триенов будет достигнута их критическая концентрация, и животные погибнут.
В свете приведенных данных, мы изучили роль разных адреналовых факторов при указанных ответах. Кортизон, дезоксикортикостерона ацетат (ДОКА) и хлорид натрия были исследованы на предмет их защитной роли в отношении токсических эффектов олеиновой и элеостеариновой кислот. Группам крыс, непосредственно после выполнения им адреналэктомии, были назначены ежедневно дозы 1 мг кортизона, 0,2 см3 ДОКА, или 1 % хлорид натрия в питьевой воде ad libitum. Адреналэктомированным крысам контрольной группы никакой поддерживающей терапии не назначали. Через три дня после адреналэктомии была назначена внутриперитонеально провоцирующая доза 1 см3 10% олеиновой кислоты из расчета на 150 г веса тела.
В то время как летальность в контрольной группе крыс составила 90%, в группе животных, леченных кортизоном, она была равна 25%. Назначение ДОКА снизило летальность только до 65%, а воздействие NaCI оказалось слабее, поскольку снижало ее лишь до 85%.
Защитное действие, направленное против олеиновой кислоты при адреналэктомии, видно из следующей таблицы:
| Средство | % Летальность |
| Контроль | 90 |
| Кортизон | 25 |
| ДОКА | 65 |
| NaCI | 85 |
Это говорит о том, что неоглюкогенный гормон играет значительную защитную роль в организме, противодействуя вредоносным эффектам жирной кислоты. Минералокортикоид, с другой стороны, вероятно, играет меньшую роль в указанном механизме. Этот факт подтверждается неэффективностью назначения натрия.
Идентичный предварительный эксперимент, выполненный для элеостеариновой кислоты, показывает такую же защитную эффективность кортизона, меньшую эффективность ДОКА и почти полное отсутствие эффекта хлорида натрия.
Глава 6, Заметка 19. Связи глюкуроновой кислоты
Изучение детоксикации-экскреции разных агентов привело к следующим выводам. Первичные алифатические спирты, кроме метилового, элиминируются вместе с глюкуроновой кислотой; то же свойственно и вторичным алифатическим спиртам, третичным алифатическим спиртам и гликолям, от пропиленгликоля и выше. Из алифатических альдегидов связывается лишь их часть и только после преобразования in vivo. В то время как большая часть алифатических кетонов образует пары, фенол и, более выраженно, крезолы и салициловая кислота, частично выделяются в качестве сульфо-спаренных, а также только частично в паре с глюкуроновой кислотой. Резорцин, катехол, орцинол, фенолфталеин, флоридзин элиминируются, главным образом, в паре с глюкуроновой кислотой, в то время как адреналин - почти в одиночку в виде сульфата. Большая часть ароматических углеводородов также связана с глюкуроновой кислотой, но только после видоизменения in vivo.
Для ароматических кислот связь с глюкуроновой кислотой обеспечивается присутствием вторых полярных групп, обычно одного или нескольких гидроксилов. Ароматические соединения азота сначала изменяются в аминогруппы, перед тем как они образуют пары с глюкуроновой кислотой. Только сравнительно малые количества сульфаниламидов выделяются связанными с глюкуроновой кислотой.
Многие из гетероциклических соединений связаны с глюкуроновой кислотой, при условии наличия амино- или гидроксильной групп; то же относится и к половым гормонам, при этом эстрогены представляют особую группу.
Общей характеристикой веществ, выделяемых в паре с глюкуроновой кислотой, является присутствие в их молекуле одной, или большего числа, положительных полярных групп - гидроксильной или аминной. Поскольку, за немногими исключениями, все указанные вещества обладают также липоидическими свойствами, экскреция, спаренных с глюкуроновой кислотой, веществ представляется средством элиминации положительных липоидов.
Глава 6, Заметка 20. Глюкуроновая кислота—механизм составления пар
Анализ проб мочи, содержащих перекиси, также выявил значительные количества компонентов глюкуроновой кислоты. Мы использовали слегка измененную методику Tollens для дозирования глюкуроновой кислоты в моче, основанную на реакции этой кислоты с нафторезорцином в кислой среде. К 5 см3 мочи были добавлены 0.5 см3 1 % раствора нафторезорцина в спирте (1.3 диоксинафталин) и 5 см3 концентрированной хлористоводородной кислоты. Смесь кипятили в течение минуты, еще пять минут отстаивали, а затем охлаждали, преимущественно в ванне с ледяной водой. В охлажденном виде, добавляли смесь 90% эфира и 10% спирта. Она добавлялась, встряхивалась и проводилось измерение сине-фиолетовый цвета образовавшегося эфиро-спирта, используя спектрофотометр. Полученные значения у разных субъектов, показали определенное увеличение количества глюкуроновой кислоты в пробах мочи, содержащих перекиси, что указывает на возможную связь между ними. Основываясь на указанной корреляции, мы исследовали одну из ролей глюкуроновой кислоты в организме – роль детоксицирующего агента.
|
|
|







