 |
10. Сравнение дроссель-эффекта с температурным эффектом адиабатного расширения
|
|
|
|
10. Сравнение дроссель-эффекта с температурным эффектом адиабатного расширения
Из курса общей термодинамики (раздел «Вычисление энтропии») известно соотношение:
 .
.
Для обратимого адиабатного процесса (dS = 0) это уравнение приобретает следующий вид:
 ,
,
откуда следует
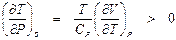 .
.
Обозначим температурный эффект обратимого адиабатного расширения как 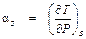 .
.
 . (10. 1)
. (10. 1)
Сравним α S с дроссель-эффектом α i (примечание: α i иногда называют температурным эффектом необратимого адиабатного процесса расширения).
 .
.
Окончательно
 . (10. 2)
. (10. 2)
Из уравнения (10. 2) следует, что при адиабатном расширении газ охлаждается сильнее, чем при адиабатном дросселировании.
Для получения низких температур, например, сжижение газов, целесообразно использовать детандеры – расширительные цилиндры, в которых производится адиабатное расширение газа.
Как было показано выше, охлаждение рабочего тела при дросселировании (α i > 0), возможно лишь при расположении начальных точек дросселирования (Р1, Т1) в определенных областях,
Так, например, при Т1> ТИНВ max охлаждение газа при дросселировании невозможно ни при каких значениях начального давления Р1.
В случае адиабатного расширения охлаждение рабочего тела (даже идеального газа) достигается всегда, при любом сочетании начальных значений термодинамических параметров (Р1, Т1).
Последнее является большим достоинством метода охлаждения за счет адиабатного расширения. Недостатком этого метода является техническая сложность осуществления регулирования температуры охлаждения. Метод дросселирования свободен от этого недостатка, но приводит к некоторому снижению эффективности работы холодильной установки.
|
|
|
Как следует из уравнения (10. 2), в области двухфазных состояний вещества, где СР → ∞, α S = α i, т. е. одинаковый перепад давления Р1 – Р2, приводит к одинаковому понижению температуры Т1 – Т2. Чем больше реальный процесс адиабатного расширения газа в детандере отличается от обратимого действием сил трения, ведущих к нагреванию газа, тем сильнее α S стремится к α i.
Процесс дросселирования из-за его необратимости приводит к снижению работоспособности газа (пара) по сравнению с адиабатным обратимым расширением. Рассмотрим два варианта расширения пара от P1 до P3:
- адиабатное обратимое расширение, при котором теоретическая работа пара равна разности i1 – i3;
- дросселирование пара от Р1 до Р2 (Р2 > Р3) с последующим адиабатным расширением пара от Р2 до Р3.
Теоретическая работа пара при таком варианте расширения будет меньше и равна разности i2 – i4, где i2 = i1, а i4 > i3. Это иллюстрируется рис. 10. 1

Рис. 10. 1. Влияние процесса дросселирования на работоспособность пара

Потеря работоспособности 1 кг пара в приведенном примере составит:
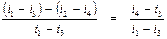 .
.
Приложение
П. 1. Вывод формулы для дифференциального дроссель-эффекта (вариант автора пособия)
 . (П1. 1)
. (П1. 1)
а) Определим  для формулы (П1. 1). Пусть i = i(T, V),
для формулы (П1. 1). Пусть i = i(T, V),
тогда
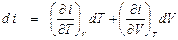 ,
,
откуда
 . (П1. 2)
. (П1. 2)
б) Определим  . Пусть i = i(Р, V),
. Пусть i = i(Р, V),
тогда
 ,
,
откуда
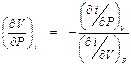 . (П1. 3)
. (П1. 3)
в) После подстановки (П1. 2) и (П1. 3) в уравнение (П1. 1) имеем:
 ,
,
 . (П1. 4)
. (П1. 4)
г) Определим  . Так как i = U + PV, то di =dU + PdV + VdP,
. Так как i = U + PV, то di =dU + PdV + VdP,
откуда:
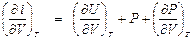 . (П1. 5)
. (П1. 5)
Определим  . Так как dU = ТdS – PdV,
. Так как dU = ТdS – PdV,
|
|
|
то:
 .
.
По третьему типу дифференциальных соотношений термодинамики
 .
.
Тогда
 . (П1. 6)
. (П1. 6)
Подставим (П1. 6) в уравнение (П1. 5):
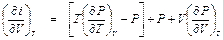 ,
,
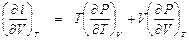 . (П1. 7)
. (П1. 7)
д) Определим  для формулы (П1. 4). Представим эту производную в виде произведения двух частных производных:
для формулы (П1. 4). Представим эту производную в виде произведения двух частных производных:
 .
.
Из общей термодинамики известно, что  = СР.
= СР.
Тогда
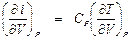 . (П1. 8)
. (П1. 8)
Общая формула для теплоемкостей однородных систем, как известно из общей термодинамик, имеет вид:
 .
.
Для изобарного процесса из этой формулы следует:
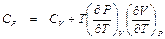 . (П1. 9)
. (П1. 9)
Подставим (П1. 9) в (П1. 8):

и
 . (П1. 10)
. (П1. 10)
е) Подставим П(1. 10) и (П1. 7) в формулу (П1. 4):
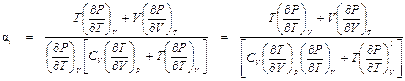 .
.
Выразим произведение 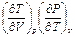 в знаменателе через произведение других частных производных, используя дифференциальные соотношения термодинамики:
в знаменателе через произведение других частных производных, используя дифференциальные соотношения термодинамики:
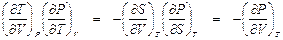 . (П1. 11)
. (П1. 11)
Тогда окончательно
 . (П1. 12)
. (П1. 12)
|
|
|


