 |
Биологическое значение экссудации двояко
|
|
|
|
Биологическое значение экссудации двояко
· Она выполняет важную защитную роль: обеспечивает доставку в ткань плазменных медиаторов и биологически активных веществ, высвобождаемых активированными клетками крови. Совместно с тканевыми медиаторами они участвуют в умерщвлении и лизисе микроорганизмов, привлечении лейкоцитов крови в очаг воспаления, опсонизации флогогена, стимуляции фагоцитоза, раневом очищении, репаративных явлениях. С экссудатом из тока крови в очаг выходят продукты обмена и токсины, то есть очаг воспаления выполняет дренажную элиминативную функцию.
· С другой стороны, вследствие свертывания лимфы в очаге, выпадения фибрина, усугубления венозного застоя и тромбирования венозных и лимфатических сосудов экссудат участвует в задержке в очаге микроорганизмов, токсинов, продуктов обмена.
Будучи компонентом патологического процесса, экссудация может приводить к осложнениям - поступлению экссудата в полости тела с развитием плеврита, перикардита, перитонита; сдавлению близлежащих органов; гноеобразованию с развитием абсцесса, эмпиемы, флегмоны, пиеми и. Образование спаек может вызвать смещение и нарушение функций органов. Большое значение имеет локализация воспаления. Так, например, образование на слизистой оболочке гортани при дифтерии фибринозного экссудата может привести к асфиксии.
Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления, как припухлость. Кроме того, наряду с действием брадикинина, гистамина, PG, нейропептидовдавление экссудата на окончания чувствительных нервов имеет некоторое значение в возникновении боли.
Резюме
|
|
|
Экссудация - выпотевание богатой белком жидкой части крови в воспаленную ткань. Сопровождает расстройства микроциркуляции в очаге воспаления и объясняется:
• повышением проницаемости сосудов за счет расширения межэндотелиальных соединений, а также повреждения эндотелия и базальной мембраны;
• увеличением гидростатического (фильтрационного) давления крови вследствие артериальной и венозной гиперемии;
• возрастанием осмотического и онкотического давления интерстициальной жидкости.
Экссудация имеет 2 фазы:
1) немедленную, завершающуюся в течение получаса и обусловленную контрактильными явлениями со стороны эндотелия венул;
2) замедленную, длящуюся до 100 ч и связанную с повреждением стенки венул и капилляров лейкоцитарными факторами - лизосомальными ферментами и активированными метаболитами кислорода.
В зависимости от качественного состава различают следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический, смешанный.
Экссудация выполняет защитную роль, обеспечивая доставку в ткань медиаторов, необходимых для уничтожения и элиминации флогогена, и выполняя дренажную функцию, однако может приводить к осложнениям - сдавлению органов, развитию абсцессов и др.
10. 4. 5. Выход лейкоцитов в воспаленную ткань (эмиграция лейкоцитов)
Эмиграция (emigratio от лат. emigrare - выселяться, переселяться) - выход лейкоцитов из сосудов в ткань. Осуществляется главным образом через стенку венул и является ключевым событием патогенеза воспаления (рис. 10. 11). Фагоцитоз и внеклеточная реализация бактерицидного и литического эффектов лейкоцитов играют решающую роль в борьбе с флогогеном. Оказывая влияние на клетки, сосуды и кровь, компоненты лейкоцитов выступают как важные медиаторы и модуляторы воспаления, в том числе повреждения собственных тканей. Осуществляя раневое очищение, фагоциты создают предпосылки для репаративных явлений, где они стимулируют пролиферацию, дифференцировку и функциональную активность фибробластов и других клеток. Механизм эмиграции (по И. И. Мечникову) состоит в явлении хемотаксиса - направленного движения лейкоцитов в очаг воспаления вдоль химического градиента.
|
|
|
Пусковым фактором активации лейкоцитов является воздействие на рецепторы их мембраны разнообразных хемотаксических агентов (хемоаттрактантов), высвобождаемых микроорганизмами или фагоцитами, а также образующихся в ткани в результате действия флогогена или под влиянием самих фагоцитов. Наиболее важными хемоаттрактантами являются фрагменты комплемента, фибринопептиды и продукты деградации фибрина, калликреин, проактиватор плазминогена, фрагменты коллагена, фибронектин, метаболиты арахидоновой кислоты, цитокины, бактериальные пептиды, продукты распада гранулоцитов.
В результате связывания хемоаттрактантов с рецепторами и активации ферментов плазматической мембраны в фагоците происходит дыхательный «взрыв» - резкое повышение потребления кислорода и образование активированных его метаболитов. Этот процесс направлен на дополнительное «вооружение» фагоцита высокореактивными токсическими веществами для более эффективного уничтожения микроорганизмов. Наряду с дыхательным «взрывом» в фагоците происходят другие изменения: активация экспрессии молекул адгезии и образование псевдоподий, необходимых для эмиграции; усиленная секреция и выделение веществ, облегчающих прикрепление лейкоцита к эндотелию (лактоферрин, катионные белки, фибронектин, IL).
Лейкоциты выходят из осевого тока крови в плазматический. Этому способствует нарушение реологических свойств крови, замедление кровотока, изменение его структуры, сокращение краевой плазматической зоны.
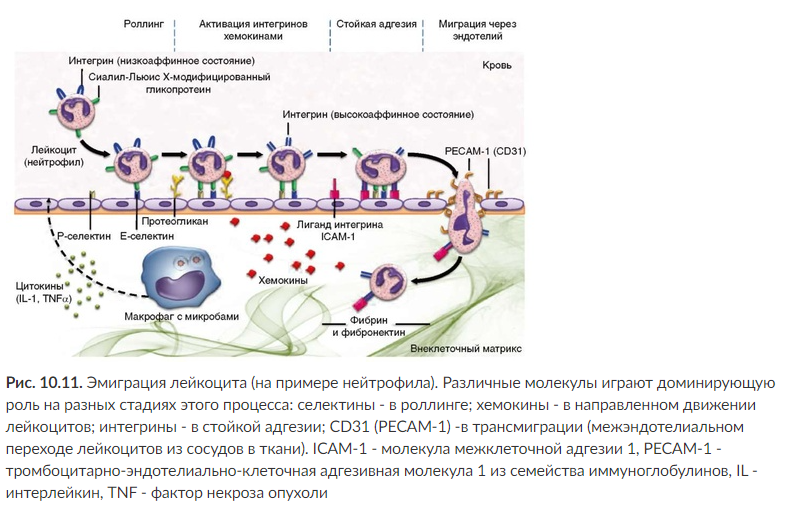
Вследствие возрастания адгезивных свойств лейкоцитов и эндотелиальных клеток происходит прикрепление лейкоцитов к эндотелию - развивается феномен краевого стояния лейкоцитов.
Патогенетическими факторами повышения адгезивности эндотелия являются:
• активация экспрессии на эндотелиоцитах адгезивных молекул (селектины P и Е, молекулы семейства Ig ICAM-1, ICAM-2, VCAM-1 и PECAM-1, кадгерин VE и др. ) (см. рис. 10. 11), а также рецепторов к IgG и фрагменту комплемента С3Ь, через которые на эндотелии фиксируются лейкоциты, несущие рецепторы к IgG и С3Ь;
|
|
|
• фиксация на эндотелиальных клетках хемоаттрактантов, взаимодействующих со специфическими рецепторами на лейкоцитах.
Прикрепление лейкоцитов к эндотелию опосредовано следующими факторами:
•лейкоциты активируются и образуют агрегаты в фазе инициации воспаления; в результате активации лейкоцита отрицательный заряд его мембраны снижается, что уменьшает силы взаимного отталкивания между лейкоцитом и отрицательно заряженным эндотелием;
• между лейкоцитами и эндотелием образуются кальциевые мостики (Са2+ и другие двухвалентные ионы играют ключевую роль в адгезии лейкоцитов);
• в ходе активации в лейкоцитах усиливается синтез специфических гранул, некоторые компоненты которых, например лактоферрин, усиливают адгезивные свойства клеток;
• на мембране лейкоцитов возрастает экспрессия адгезивных молекул (селектин L, ICAM-1, интегрины и др. ), взаимодействующих с молекулами адгезии сосудистого эндотелия (см. рис. 10. 11).
Первоначальный контакт лейкоцитов с эндотелием является весьма непрочным, и под влиянием кровотока они могут перекатываться по поверхности эндотелиального слоя сосудистой стенки, однако контакт быстро стабилизируется, поскольку лейкоциты выделяют в зону слипания протеазы, обнажающие лектиноподобные участки мембраны эндотелиоцитов и придающие им повышенную адгезивность. Стимулирует прилипание фагоцитов к эндотелию выделяемый ими фибронектин. Занявшие краевое положение лейкоциты выпускают псевдоподии, которые проникают в межэндотелиальные щели и таким образом «переливаются» через эндотелиальный слой (см. рис. 10. 11). Эмиграции способствуют повышение сосудистой проницаемости и усиление тока жидкости из сосуда в ткань, существенно облегчающие прохождение сосудистой стенки для лейкоцита.
Оказавшись между эндотелиальным слоем и базальной мембраной, лейкоцит выделяет лизосомальные ферменты и катионные белки, изменяющие коллоидное состояние базальной мембраны (обратимый переход из геля в золь), что обеспечивает повышенную проходимость ее для лейкоцита. Эмигрировавшие лейкоциты отделяются от наружной поверхности сосудистой стенки и амебоидными движениями направляются к центру очага воспаления, что определяется градиентом концентрации хемотаксических веществ в очаге. Некоторую роль могут играть электрокинетические явления, обусловленные разностью потенциалов между отрицательно заряженным лейкоцитом и положительным зарядом ткани в очаге воспаления вследствие Н+-гиперионии.
|
|
|
Первоначально среди лейкоцитов экссудата в очаге острого воспаления преобладают гранулоциты, в основном нейтрофилы, а затем - моноциты/ макрофаги. Позже в очаге накапливаются лимфоциты (рис. 10. 12).
Мигрирующему нейтрофилу достаточно 3-12 мин, чтобы пройти эндотелий, поэтому гранулоциты появляются в очаге уже к 10-й минуте от начала воспаления. Скорость аккумуляции нейтрофилов в очаге максимальна в первые 2 ч, после чего постепенно снижается. Количество их достигает максимума через 4-6 ч. В этот период лейкоциты очага представлены нейтрофилами более чем на 90%. Гранулоциты фагоцитируют бактерии и иные инородные тела, частицы отмирающих клеточных элементов, выделяют ферменты, катионные белки, активированные метаболиты кислорода. Одновременно происходит массивное разрушение нейтрофилов, продукты распада которых являются важным стимулом расширения инфильтрации, в том числе привлечения в очаг моноцитов.
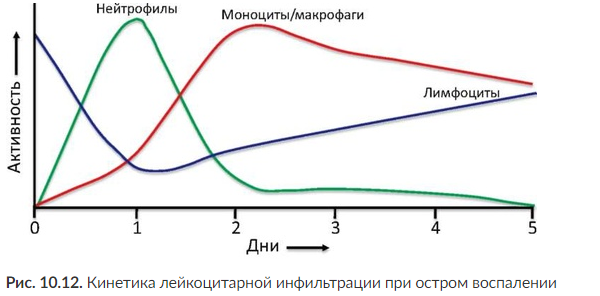
Моноциты появляются в очаге острого воспаления (рис. 10. 12, 10. 13) спустя 16-24 ч, максимальная их аккумуляция регистрируется, как правило, на третьи сутки. Однако миграция моноцитов из крови в ткань начинается одновременно с миграцией нейтрофилов, но тормозится под влиянием продуктов жизнедеятельности нейтрофилов в течение определенного времени, необходимого для полной выраженности нейтрофильной реакции и предупреждения ее моноцитарного контроля. В очаге воспаления моноциты созревают в макрофаги. Моноциты/ макрофаги являются источником медиаторов воспаления (ферментов, актививированных метаболитов кислорода, цитокинов), фагоцитируют бактерии и клеточный детрит, в частности фрагменты погибших нейтрофилов. О зависимости аккумуляции моноцитов в очаге от предшествующей ей эмиграции нейтрофилов свидетельствуют результаты эксперимента, показавшего, что у кроликов с нейтропенией моноциты не появляются в очаге воспаления в течение 16 ч, в то время как в естественных условиях воспаления они обнаруживаются уже через 4 ч. Введение животным с лейкопенией нейтрофилов непосредственно в очаг воспаления восстанавливает обычную аккумуляцию мононуклеаров. Известен также хемотаксический эффект на моноциты лизатов нейтрофилов, обусловленный отчасти катионными белками их лизосомальных гранул.
|
|
|
Раневое очищение происходит главным образом путем внеклеточной деградации поврежденной ткани и фагоцитоза. Оно осуществляется под регуляторным влиянием цитокинов с помощью ферментов катаболизма протеогликанов, а также коллагеназы, желатиназы и др. Активация этих ферментов может происходить при действии активатора плазминогена, высвобождаемого при участии цитокинов из мезенхимальных клеток. PG также могут индуцировать протеиназы и вносить свой вклад в процессы деградации.
Клеточный состав экссудата во многом зависит от характера и течения воспаления, что, в свою очередь, определяется природой флогогена и состоянием реактивности организма. Так, экссудат особенно богат нейтрофилами, если воспаление вызвано гноеродными микроорганизмами; при аллергическом воспалении в нем преобладают эозинофилы. Хроническое воспаление характеризуется незначительным содержанием нейтрофилов и большим количеством моноцитов и лимфоцитов в экссудате.
Эмигрировавшие лейкоциты совместно с пролиферирующими клетками местного происхождения образуют воспалительный инфильтрат. При этом экссудат с содержащимися в нем клетками пропитывает ткань, распределяясь между элементами воспалительного участка и делая его напряженным и плотным. Инфильтрат наряду с экссудатом обусловливает припухлость и имеет значение в возникновении воспалительной боли.
Резюме
Эмиграция - выход лейкоцитов из сосудов в ткань. Эмиграция лейкоцитов в очаг воспаления необходима для осуществления раневого очищения и последующих репаративных процессов в поврежденной ткани. Пусковым фактором эмиграции является действие на рецепторы мембраны лейкоцитов хемоаттрактантов, высвобождающихся микроорганизмами или образующихся в ткани.
Выход лейкоцитов из сосуда - сложный процесс, связанный с их адгезией на эндотелии и краевым стоянием (маргинацией), затем межэндотелиальным выходом и миграцией в очаг воспаления в направлении хемотаксического стимула.
В первые сутки в очаге острого воспаления преобладают нейтрофилы, позднее появляются моноциты/макрофаги. Лейкоциты уничтожают микроорганизмы путем фагоцитоза и высвобождения медиаторов повреждения, что сопровождается разрушением окружающих очаг клеток и межклеточного вещества.
|
|
|


