 |
Глава 3 финансы в здравоохранении 35 глава
|
|
|
|
где BCR (benefit-cost ratio) - соотношение затраты - выгода; B - выгода (в денежном выражении); C - затраты; CBD (cost-benefit difference) - абсолютная разница между затратами и выгодой в денежном выражении.
Для определения денежного выражения «выгоды» от применения медицинских технологий применяется несколько подходов: методика «человеческого капитала», оценка «выявленных предпочтений» и оценка «готовности платить».
К вспомогательным видам клинико-экономического анализа относится прежде всего анализ «стоимость болезни» (cost of illness - COI) - метод, предполагающий расчет всех затрат, связанных с ведением больных с определенным заболеванием на определенном этапе (отрезке времени) или на всех этапах оказания медицинской помощи. Данный анализ не предполагает сравнения эффективности медицинских технологий и применяется для изучения типичной практики ведения больных с каким-либо заболеванием. Исторически первые попытки экономического анализа в медицине были связаны именно с расчетом «стоимости болезни»; этот анализ широко применяется для решения определенных задач - таких, как планирование затрат, определение тарифов для расчетов между субъектами системы здравоохранения и медицинского страхования и т.п. В некоторых странах (например, в США) для большинства заболеваний
рассчитана «стоимость болезни», и эти расчеты использовались для обоснования системы стандартов по диагностически-родственным группам; в других странах (в Европе) «стоимость болезни» изучена для наиболее часто встречающихся заболеваний.
В условиях российского здравоохранения расчет «стоимости болезни» необходим в связи с тем, что издержки на оказание медицинской помощи пациентам со многими заболеваниями до сих пор не определены. Огромные данные по «стоимости болезни» накоплены СМО, работающими в системе ОМС и особенно - ДМС, но эти данные не анализируются и не публикуются; вполне вероятно, что часть из них безвозвратно утеряна.
|
|
|
Вместе с тем при наличии доступа к этим данным следует иметь в виду их недостоверность - врачи, менеджеры здравоохранения в негосударственных, а нередко и в государственных медицинских организациях, занимаются приписками услуг и лекарств в целях «освоения» как можно больших объемов финансовых средств, а страховые компании в большинстве случаев лишены влияния на этот процесс. Одновременно показатели объемов медицинских услуг и лекарств далеки от оптимальных.
ABC-анализ - распределение (ранжирование) отдельных медицинских технологий по доле затрат на каждую из них в общей структуре расходов - от наиболее затратных к наименее затратным с выделением 3 групп. В группу A относят технологии, на которые приходится 80% затрат (закономерно в группе оказывается 10-15% от числа всех использованных технологий), в группу B - технологии, потребовавшие 15% средств (до 20-30% от общего числа) и в группу C - технологии, издержки на выполнение которых составили 5% от затрат (обычно более 50% исследуемого ассортимента). Метод используется для определения приоритетов и целесообразности расходования средств на основе ретроспективной оценки реальных затрат.
Частотный анализ - ретроспективная оценка частоты применения той или иной технологии, что в сочетании с учетом затрат на каждый вид услуги или ЛС позволяет определить, на какие виды помощи уходит основная доля расходов - массовые и дешевые или редко применяющиеся, но дорогие.
VEN-анализ - распределение медицинских технологий по степени их значимости: V (vital) - жизненно необходимые, E (essential) - важные, N (non-essential) - второстепенные (неважные, незначимые).
|
|
|
Все 3 анализа взаимодополняют друг друга и, как правило, проводятся одновременно. ABC- и VEN-анализы вначале рекомендовали использовать на уровне учреждения здравоохранения для оценки структуры расходов и выявления случаев нерационального распределения финансов. Например, нерациональным считается преобладание в группе А второстепенных лекарственных препаратов (N). На основе результатов ABC-, частотного и VEN-анализа можно разработать рекомендации по составлению и дальнейшему совершенствованию формуляра медицинской организации или списка льготного отпуска лекарств.
Моделирование - способ изучения различных объектов, процессов и явлений, основанный на использовании математических (логических) моделей, представляющих собой формализованное
описание изучаемого объекта (пациента, заболевания, эпидемиологической ситуации) и его динамику при использовании медицинских технологий.
Дисконтирование - введение поправочного коэффициента при расчете затрат (а иногда и эффективности) с учетом влияния временного фактора: затраты, которые предстоит понести в будущем, менее значимы, чем понесенные сегодня, и напротив, выгода, приобретенная сегодня, более ценна, чем предстоящая в будущем.
Анализ чувствительности устанавливает, в какой степени будут меняться результаты исследования при изменении исходных параметров (например, колебаниях цен на лекарственные препараты, изменении частоты побочных эффектов и т.п.).
Все описанные выше методики не являются специфическими для клинико-экономического анализа и широко используются в различных типах эпидемиологических, экономических и управленческих исследований.
Исследования с использованием базисных методов клинико-экономического анализа проводятся в основном научно-исследовательскими организациями и Обществом фармако-экономических исследований. В медицинских организациях специалисты чаще используют вспомогательные методы: расчет «стоимости болезни», АВС-, частотный и VEN-анализы структуры расходов. Кроме того, в медицинских организациях необходимо уметь интерпретировать результаты клинико-экономических исследований с целью их использования для формирования стандартов и формуляров.
|
|
|
Принципы клинико-экономического анализа
Комплексный подход к анализу целесообразности применения альтернативных медицинских технологий должен быть основан на ряде принципиальных подходов.
1. Альтернативность. Чтобы сделать правильный выбор конкретной технологии как на индивидуальном, так и на популяционном уровне (при принятии клинических и административно-управленческих решений), необходимо выявить все имеющиеся альтернативы и провести их сравнительный анализ.
2. Количественный анализ. Для объективного выбора обязательно проводят не только сравнительный качественный, но и количественный анализ имеющихся альтернативных вариантов (расчет показателей эффективности, стоимости и соотношения затраты-эффект для исследуемых технологий).
3. Определение точки (угла) зрения исследования. Выбор может быть сделан правильно только в том случае, если ясно обозначена точка (угол) зрения исследования, т.е. отчетливо сформулировано, в интересах какой группы населения, какого учреждения или в рамках какого бюджета (общества, страховой компании, кошелька пациента и т.д.) должен быть сделан выбор.
4. Комплексность. Комплексный анализ целесообразности применения медицинских технологий предполагает взаимосвязанную оценку последствий (результатов) и затрат на медицинские технологии. Наиболее важна в данном определении именно взаимосвязанная оценка, т.е. речь идет не просто о сравнении затрат, а об оценке соотношения между затратами и результатами. С точки зрения практической реализации это означает, что целью является не поиск наиболее
дешевых технологий (очень может быть, что наиболее дешевый вариант - не лечить вообще, хотя серьезных доказательств справедливости этого утверждения нет), а расчет затрат, необходимых для достижения желаемой эффективности, и соотнесение этих затрат с возможностями бюджета.
1. Доказательность. В основу клинико-экономического анализа берут исследования, в которых с той или иной степенью достоверности доказаны определенные клинические эффекты применения медицинских технологий, проведена убедительная оценка затрат.
|
|
|
Этапы клинико-экономического анализа с применением основных методов Клинико-экономический анализ медицинских технологий проводится в несколько этапов.
• Подготовительные мероприятия.
1. Изучение имеющихся данных об эффективности, безопасности и экономической целесообразности применения исследуемой технологии и о проблеме в целом (публикации, отчеты, оценка типичной практики), формулировка исследуемой проблемы.
2. Выбор альтернативной технологии (технологий) для сравнения с исследуемой.
3. Выбор критериев оценки эффективности исследуемых технологий.
4. Формирование цели и задач исследования, определение точки (угла) зрения исследования, планирование дизайна исследования, выбор метода проведения клинико-экономического анализа (затраты-эффективность, затраты-полезность, затраты-выгода, минимизации затрат).
• Исследовательская часть.
1. Анализ эффективности и безопасности альтернативных технологий.
2. Расчет затрат, связанных с применением исследуемых технологий.
3. Проведение непосредственно клинико-экономического анализа, при необходимости - построение и анализ моделей.
4. Проведение дисконтирования и анализа чувствительности.
• Написание отчета.
В результате исследования с использованием базисных методов клинико-экономического анализа получают соотношение затраты-эффективность
для исследуемых технологий и показатель соотношения разницы затрат на применение исследуемых технологий и разницы в их эффективности (приращение эффективности затрат, или инкрементальный показатель затраты-эффективность).
Например, проводился клинико-экономический анализ препарата бортезомиб (велкейд) по сравнению с дексаметазоном при множественной миеломе, резистентной к химиотерапии, в условиях российского здравоохранения с целью обоснования использования бортезомиба в системе дополнительного лекарственного обеспечения (ДЛО). Были получены следующие данные.
Бортезомиб является более эффективной и существенно более дорогой альтернативой, чем дексаметазон. Разница в затратах на применение 2 альтернативных схем терапии составляет 1 822 774 руб. (затраты рассчитаны на основании цен, зарегистрированных в Перечне торговых наименований ЛС, предназначенных для лекарственного обеспечения граждан, имеющих право на государственную социальную помощь в виде набора социальных услуг, действующего на момент проведения исследования).
Разница в эффективности, по данным клинического исследования APEX, дополненного моделью для оценки отдаленных результатов, составляет 2,7 года сохраненной жизни.
|
|
|
Таким образом, показатель приращения эффективности затрат составляет:
1 822 774,00:2,7 = 792 510,43 руб. на год сохраненной жизни.
В зарубежных странах, где клинико-экономический анализ используется для принятия решений о финансировании медицинских технологий, интерпретация результатов клинико-экономического анализа осуществляется путем сопоставления показателя приращения эффективности затрат (для более затратной и более эффективной технологии по сравнению с менее затратной и менее эффективной) с нормативной, согласованной величиной, являющейся условным порогом экономической целесообразности. Порог бывает явным или скрытым, представленным в виде определенного значения или интервала значений. При интерпретации результатов принимаются во внимание не только величина соотношения затраты-эффект, но и социальная значимость, тяжесть болезни, для лечения которой предназначена исследуемая технология.
Так, в Великобритании c 1999 г. специально организованный Институт здоровья и клинического совершенствования (NICE) дает рекомендации правительству о целесообразности применения в Национальной службе здравоохранения различных медицинских технологий. Явно установленного порога экономической целесообразности у института нет, но анализ его рекомендаций показал, что при стоимости года качественной жизни (QALY) менее 5-15 тыс. англ. фунтов скорее всего технология будет признана затратно-эффективной, более 25-30 тыс. - отклонена. Однако принимаются во внимание и другие факторы - такие, как тяжесть болезни, наличие альтернативного лечения, инновационный характер технологии. Например, применение Р-интерферона и глатирамера ацетата для лечения рассеянного склероза было признано неприемлемым из-за чрезмерно высокого показателя приращения затрат (35-580 тыс. англ. фунтов на QALY - в зависимости от метода расчета и длительности лечения) и неоднозначных данных об эффективности. Напротив, иматиниб для лечения хронического миелолейкоза был одобрен как целесообразное средство лечения этого тяжелого заболевания, для терапии которого не существует эффективных методов, при показателе приращения затрат 37-49 тыс. англ. фунтов на QALY.
В России в настоящее время нет согласованного значения величины показателя приращения затрат (стоимости года сохраненной жизни или года качественной жизни), в связи с чем интерпретация результатов клиникоэкономических исследований носит субъективный характер. Возможно сопоставление полученного в исследовании показателя с аналогичным показателем для технологий, уже использующихся в системе здравоохранения.
Например, если проводился клинико-экономический анализ нового ЛС на предмет включения его в формуляр, можно сравнить величину показателя приращения затрат с таковым для лекарства, уже имеющегося в формулярном списке.
В приведенном выше примере клинико-экономического анализа применения бортезомиба при множественной миеломе было сделано следующее заключение. Показано, что применение препарата плавикс (клопидогрель, на момент проведения исследования входил в перечень для дополнительного лекарственного обеспечения отдельных категорий граждан) для профилактики ишемических событий у лиц высокого риска в течение 3 лет характеризуется затратами 1 044 тыс. руб. на год сохраненной жизни. В этом плане применение бортезомиба экономически не менее целесообразно.
Проведение АВС-, частотного и VEN-анализов в медицинской организации
В медицинской организации основное внимание должно быть уделено проведению АВС-, частотного и VEN-анализов; они объединяются термином «совокупный анализ затрат» и могут быть использованы, кроме того, страховой организацией, фондом ОМС или органом управления здравоохранения. В зависимости от того, кто проводит этот анализ, обозначается точка (угол) зрения исследования, так как цели исследования, а главное, выводы и применение результатов, могут быть принципиально различными.
Для проведения этих видов анализа выбирают объекты (медицинские услуги, ЛС, болезни и т.д.), на которые за определенный период времени были израсходованы финансовые средства из бюджета организации.
АВС-анализ позволяет быстро и наглядно изучить распределение затрат.
Продемонстрируем методику АВС-анализа на примере ЛС.
Все препараты, примененные у больных с определенным заболеванием (в подразделении или в целом по организации - в зависимости от задач анализа), заносят в таблицу: от наиболее ресурсоемких к наименее ресурсоемким. Напротив каждого препарата указывают затраты на него, в последней строке таблицы суммируют общие затраты.
Затем для каждого лекарства определяют долю затрат на него (в %) и рассчитывают так называемый накопительный (кумулятивный) процент. Напротив 1-го ЛС в ранжированном списке указывают долю затрат на него, для 2-го - долю затрат суммируют с таковой на 1-й препарат; для 3-го суммируют доли затрат на 3-й, 2-й и 1-й препараты и т.д. Когда накопительный процент достигает 80, подводят черту под группой А и начинают формировать аналогичным путем группу В, добирая кумулятивный процент до 95. Все остальные ЛС (5% затрат) составят группу С.
В зависимости от позиции исследования можно проводить разные виды АВС-анализа ЛС:
1. Анализ закупок различных ЛС (препаратов) на уровне подразделения, медицинской организации, региона, в отдельной группе (например, льготного отпуска), отдельной службе или ведомстве, в стране в целом (например, ввоз лекарственных препаратов в Россию).
2. Анализ лекарств, применяемых при определенной патологии (пример приведен ниже).
3. Анализ закупок и применения ЛС определенных групп (оптимально сведение лекарств в фармакотерапевтические группы).
4. Анализ использования определенных препаратов внутри одной фармакотерапевтической группы (например, антибиотики или гипотензивные средства).
5. Анализ расходов на оригинальную и генерические формы одного ЛС.
Каждый из видов АВС-анализа имеет самостоятельное значение. В классическом варианте АВС- анализ лекарств проводится по торговым названиям, однако для повышения информативности можно свести некоторые препараты в группы, согласно непатентованным наименованиям: все виды инсулинов, пентоксифиллин во всех лекарственных формах, дротаверин во всех лекарственных формах и т.д.
Для анализа медицинских услуг выполняют следующие виды АВСанализа:
1. Анализ медицинских услуг на уровне подразделения, медицинской организации, региона в целом.
2. Анализ медицинских услуг, выполняемых при определенном заболевании.
3. Анализ медицинских услуг определенного типа (лабораторных или инструментальных исследований, операций) или иных групп (платных медицинских услуг).
Частотный анализ дополняет АВС-анализ и предполагает ранжирование выбранных позиций по частоте применения - от часто применяемых к редко применяемым. В другом варианте (и он, наверное, более правильный) указывается частота применения каждой медицинской технологии в таблице, ранжированной на группы А, В и С. Такой подход позволяет уточнить, насколько часто использовались медицинские технологии, на которые были затрачены основные расходы: основные затраты могут быть связаны как с часто повторяющимися, но дешевыми услугами, так и с редкими, но имеющими очень высокую стоимость. При этом если препарат очень дорогой, но применялся очень редко (к примеру, у одного «непрофильного» больного), его исключают из группы А для дальнейшего анализа.
Рассмотрим конкретный пример оценки типичной практики лечения больных с критической ишемией нижних конечностей. Была осуществлена выборка из 105 историй болезни. Как видно из представленных в табл. 33 данных, 80,7% расходов приходится на 23 ЛС, что составляет всего 13% от списка применявшихся лекарств.
Таблица 33. Затраты на препараты группы А (при проведении АВС-анализа)

Окончание табл. 33
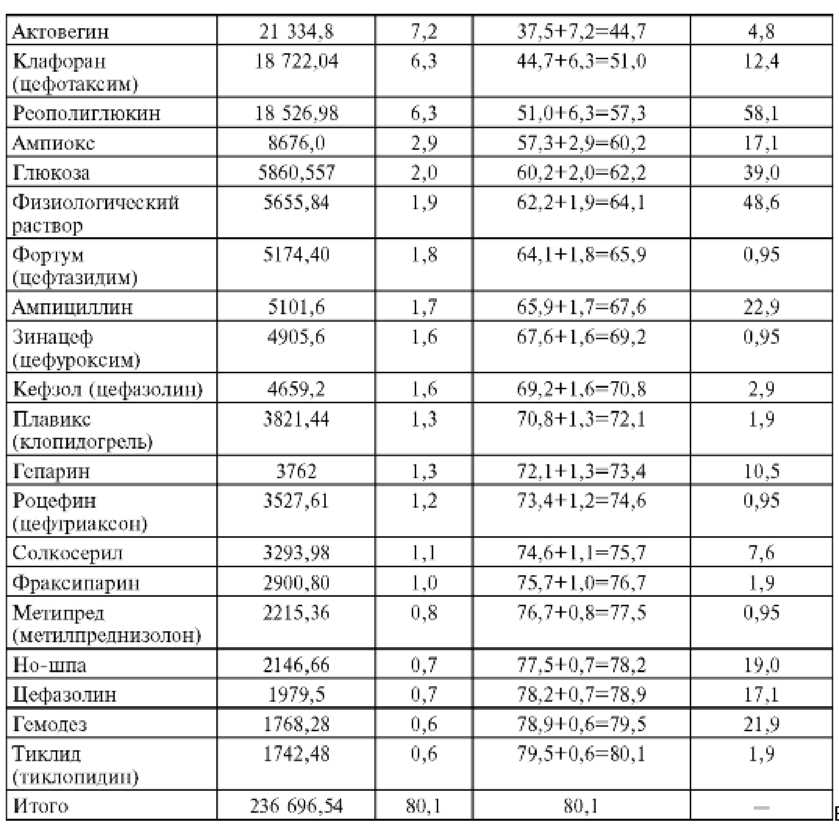
На примере среди препаратов группы А оказались как относительно недорогие и часто используемые ЛС, так и препараты с высокой стоимостью, назначавшиеся ограниченному числу больных. Максимальная доля расходов (27,1%) приходится на препараты инсулина; 2-е место занял пентоксифиллин - его назначали 81 (77,1%) больному. Третьим по объему расходов шел актовегин - его получали всего 5 пациентов, но из-за высокой стоимости на него пришлось 7% всех затрат на лекарства. Далее шли клафоран, реополиглюкин и ампиокс (соответственно 6,3; 6,3 и 2,9%). Расходы на остальные ЛС составляли не более 2% на каждое в отдельности.
В целом, у больных с критической ишемией нижних конечностей наиболее часто (не менее чем у каждого 5-го, т.е. более чем в 20% случаев) применялся 21 препарат. Чаще всего использовали пентоксифиллин (у 81 больного), реополиглюкин (у 61), а также физиологический раствор (в качестве основы для внутривенных инфузий), глюкозу, аспирин, анальгин, промедол, препараты инсулина, аскорбиновую кислоту, димедрол, ксантинола никотинат, нитросорбид, никотиновую кислоту, реланиум, ампициллин, витамин Въ гемодез, мазь левомеколь, лидокаин и перекись водорода. Остальные препараты в совокупности применялись менее чем у 20% больных.
Обращает на себя внимание, что у больных мало применялись препараты, патогенетически воздействующие на заболевание - антиагреганты, антикоагулянты и др., хотя отдельным пациентам их назначали. Следовательно, уже на этом этапе можно говорить о клинической неадекватности проводимой терапии.
Антибактериальную терапию получали 59 (56,2% больных), из них 27 пациентов - 2 антибактериальных средства и более, в том числе 5 пациентов - 4 и более (например, гентамицин + зиноцеф + кефзол + клафоран; ампиокс + гентамицин + клафоран + линкомицин; ампиокс + ампициллин + гентамицин + сульфадиметоксин + цефазолин и т.п.). В данном случае следует тщательно изучить микробиологический паспорт в отделении, оценить совместимость препаратов и т.д.
VEN-анализ используется для оценки рациональности назначения ЛС по предложению ВОЗ уже около 20 лет и предполагает присвоение примененным технологиям определенного «индекса» важности: V - жизненная необходимость, E - важность, значимость, N - отсутствие значимости каждой анализируемой позиции. В зависимости от задач анализа можно несколько иначе трактовать индексы, например: V - абсолютное значение для точной диагностики, этиотропного или патогенетического лечения, E - важность высока, но не абсолютна, N - важность вызывает сомнение.
При использовании этого вида анализа в нашей стране стало очевидным, что целесообразно использовать 2 подхода - формальный (проверка на соответствие нормативным документам) и экспертный (оценка значимости технологии с позиции конкретного заболевания).
Определить индекс VEN для ЛС по формальным параметрам можно, например, выяснив, входит ли данное средство в Перечень жизненно необходимых и важнейших ЛС, утвержденный Правительством РФ, или в формулярный перечень субъекта Российской Федерации, в принятые стандарты (протоколы ведения больных). Такой формальный подход в наибольшей степени соответствует точке зрения менеджеров здравоохранения и позволяет оценить, насколько соблюдаются установленные нормативными документами требования. В этом случае остаются 2 буквы для присвоения ЛС: V - входящее в нормативный документ и N - лекарство в документах не значится.
Другой способ - экспертный, когда эксперт оценивает необходимость, возможность или ненужность лекарства при данной патологии. Здесь очень важны профессионализм и ответственность эксперта, дающего заключение, его понимание того, что от него требуется.
Так, в одном из опубликованных исследований эксперт при анализе применения ЛС при ревматоидном артрите отнес к группе V преднизолон, а к группе E - нестероидные противовоспалительные препараты. И по формальному, и по экспертному признаку они должны относиться к группе V, без их применения больные не будут получать адекватного лечения (не будем обсуждать методологию терапии ревматоидного артрита). Перед экспертом была поставлена задача «разобрать» по группам только преднизолон и НПВП, другие препараты в исследовании не учитывались. Возможно, эксперт посчитал, что преднизолон дают тяжелобольным, которым «уже ничто не поможет», а НПВП - базовая, «рутинная» терапия. Его выводы представляются неадекватными. Вероятнее всего - из-за неправильно сформулированной задачи.
Обоснованием VEN могут являться данные клинических и клинико-экономических исследований. Строго говоря, для присвоения индекса V необходимо иметь доказательства эффективности
препарата с точки зрения спасения жизни или радикального излечения больных. Желательно использовать и сопоставлять мнение нескольких экспертов по отнесению тех или иных препаратов к группе V, E или N. Для проведения опроса необходима матрица, в которой эксперт отмечает присваиваемый индекс. Важно, чтобы эксперты проводили индексацию независимо друг от друга.
После получения независимых экспертных оценок исследователь сводит их воедино и очно просит прийти к соглашению относительно различий в оценках по отдельным препаратам. Если консенсуса нет, исследователь должен принять решение об индексации ЛС, базируясь как на мнении экспертов, так и на приведенной ими аргументации и с учетом всей совокупной внешней (зачастую - неспецифической) информации.
В дальнейшем VEN-индексация, по всей вероятности, претерпит изменения, в ней появятся более точные градации. Так, группа V обобщает сразу несколько несоединимых препаратов: с одной стороны - те, без которых пациент погибнет (например цитостатики, инсулины, антибиотики), с другой - средства лечения язвы желудка или противоастматические, которые, не спасая жизнь, существенно модифицируют течение болезни. Группа Е, по всей вероятности, будет раскрываться дополнительными индексами: безусловное Е, с которым согласны все эксперты; условное Е, по которому экспертам не удается договориться, а доказательств недостаточно; симптоматическое Е - препарат, безусловно, показан, но не для лечения самого заболевания, а для часто сопутствующего состояния (например, инсулин при инфаркте миокарда - явно не V, но сахарный диабет встречается у этих больных часто, в такой ситуации препарату следует присвоить индекс E).
В группу N попадут препараты, не оказывающие никакого действия, и препараты, которые абсолютно не нужны при данном заболевании (в частности, противопоказаны). Таким образом, и группа N окажется не столь мономорфной.
Результаты VEN-анализа, проведенного обоими способами (формальным и экспертным), могут быть объединены в одну таблицу: один столбец будет содержать результаты экспертной оценки важности препаратов, другой - формальной оценки. Очевидно, что эти две оценки могут не совпасть, что само по себе должно послужить основой для дальнейшего анализа и размышлений. Представляется, что более важными для принятия решения будут экспертная оценка и согласованное мнение специалистов.
Продолжим пример.
Лекарственная терапия в группе больных с критической ишемией нижних конечностей в стационаре («типичная практика») характеризовалась большим разнообразием. Полный список лекарственных препаратов, применявшихся в этой группе больных, составил 167 наименований. Больным назначали от 1 до 41 препарата (в среднем - 12,9± 8,6 ЛС).
Среди наиболее часто назначаемых встречались как препараты из группы V, так и из группы N (например, димедрол, аскорбиновая кислота,
витамин В1). Некоторые из этих препаратов лишь формально относятся к группе V, поскольку входят в Перечень жизненно необходимых и важнейших ЛС, но, с точки зрения эксперта, для лечения обсуждаемой патологии таковыми не являются (например, НПВП, но-шпа и др.).
Обсуждается эффективность, а стало быть, и целесообразность назначения при этой патологии пентоксифиллина (табл. 34).
При проведении формального VEN-анализа определяли, входит ли данное ЛС в Перечень жизненно необходимых и важнейших ЛС (V - входит, N - не входит), также проставлялся индекс важности с точки зрения экспертов. При этом к категории V относили препараты, безусловно воздействующие на патогенетические механизмы развития заболевания, к категории E - симптоматические средства и лекарственные препараты, традиционно используемые без серьезных доказательств клинической эффективности, а также средства для лечения сопутствующих заболеваний; и наконец, к группе N - средства, применение которых, по мнению эксперта, при данной патологии не оправдано.
Анализ показал, что в группе А 9,6% средств было затрачено на препараты, являющиеся ненужными в данной клинической ситуации (N), а 48,3% - на препараты, не являющиеся, по мнению экспертов, патогенетически оправданными при этой патологии.
В целом, после проведения всех 3 видов анализа, табл. 34 модифицируется, и из нее уже можно получить информацию для дальнейшего принятия решения. Каждый со своей позиции может сделать те или иные выводы о рациональности затрат, об их недостаточности, или, наоборот, избыточности.
Таблица 34. АВС-, VEN- и частотный анализы затрат на лекарственные препараты при критической ишемии нижних конечностей (группа «А»)

Окончание табл. 34

|
АВС-, VEN- и частотный анализ можно применить и для анализа бремени болезней для бюджета (больницы, страховой компании, субъекта Федерации или территориального фонда ОМС, страны в целом). В таком ракурсе АВСанализ - это затратные и малозатратные болезни, частотный - частота обращений за медицинской помощью (можно дифференцировать по условиям - амбулаторно, стационарно), а VEN-анализ - угрожающие жизни болезни и незначимые болезни (может быть рассмотрена и позиция общества, например инвалидизирующие болезни, являющиеся существенным социальным бременем, - индекс V).
Если встает вопрос об АВС-анализе заболеваний, то здесь правила расчета остаются прежними, однако на верхней строке оказывается заболевание, потребовавшее больше всего затрат. Очевидно, что в зависимости от того, какие затраты на заболевание учитываются, будут различаться и полученные выводы. Так, если учитываются затраты на заболевание в больнице, то иерархия одна, если затраты на заболевание, курируемое в амбулаторных условиях, - другая, если учитываются все затраты, включая «скорую помощь», - третья.
Также очевидно, что если к прямым медицинским затратам прибавить немедицинские, связанные с обеспечением социальной помощи, оплатой дней нетрудоспособности и т.д., то общие затраты на заболевание могут вырасти кратно. Так, госпитальное лечение инсульта относительно недорого, не очень дорого и собственно амбулаторное лечение последствий инсульта, но очень важна с экономической точки зрения ранняя (с 1 суток) реабилитация: если пациент, перенесший инсульт, не может осуществить элементарный самоуход, связанное с ним экономическое бремя для общества возрастает в 4 раза (сиделка либо родственники должны ухаживать за таким больным постоянно). Показано, что у больных с хронической обструктивной болезнью легких самой затратной составляющей является не госпитализация, а вызов «скорой помощи».
|
|
|


