 |
3.4.2. Плазменные тканевые культуры
|
|
|
|
3. 4. 2. Плазменные тканевые культуры
В основу метода положены принципы, разработанные Каррелем-Барроузом (1910). Кусочки ткани измельчают, как правило, до 1…2 мм, отмывают сбалансированным солевым раствором от форменных элементов крови и помещают в стерильную емкость (пробирки, матрасы, флаконы и др. ) с питательной средой, где их фиксируют на стенках свернувшейся куриной плазмой в присутствии эмбрионального экстракта. Фиксацию проводят следующим образом: тонко оттянутой пастеровской пипеткой в пробирку вносят 2 капли куриной плазмы, вращательными движениями смачивают стенки нижней трети пробирки, а затем пастеровской пипеткой вносят 8…10 кусочков ткани, а на дно — каплю эмбрионального экстракта. Снова вращательными движениями смешивают плазму с экстрактом. Плазма свертывается и фиксирует кусочки тканей на стенках пробирки, которую закрывают резиновой пробкой и помещают в термостат при 37…38º С. Через 1…2 дня вокруг кусочков появляется слой новообразовавшихся клеток, а на 5…7-й день — широкий ореол фибробластов. Питательную среду заменяют в зависимости от скорости роста клеток. При заражении такой культуры ткани будет видно цитопатическое действие вируса.
Свернувшуюся куриную плазму, как основу для развивающейся ткани, пытались заменить перфорированными целлофановыми пленками, стекловатой, агаром, тонким слоем пластмасс, прикреплением кусочков тканей к разогретым стенкам пробирок. Однако она остается самой лучшей основой, хотя в отдельных случаях может разрушаться под действием протеолитических ферментов некоторых тканей.
Правильно приготовленные кусочки органов сохраняют in vitro свою структуру и функции в течение нескольких дней, а иногда и недель. В подобном варианте метод широко использовали на ранних стадиях изучения клеточных культур. Постепенно эта техника выделилась в новое, обособленное направление, получившее название органного культивирования. Сущность метода заключается в том, что исследуемым материалом заражают тканевые эксплантаты — кусочки органов, выращиваемых на питательной среде, которая ограничивает рост соединительнотканных элементов, но поддерживает структуру и жизнедеятельность функциональных клеток. Фрагменты органов и кусочки тканей располагают на границе раздела жидкой питательной и газовых сред, они как бы плавают на поверхности. Известны разнообразные методики культивирования: использование поверхности плотных питательных сред в виде свернутой плазмы или агара, выращивание на «плоту» из миллипоровых фильтров или папиросной бумаги на поверхности питательной среды, культивирование на «платформе», наповерхности хорионаллантоисной оболочки 7-дневных куриных эмбрионов и пр.
|
|
|
Для обнаружения цитопатических изменений, вызванных вирусом проводят гистологическое исследование органных культур на срезах. Но иногда эти изменения можно обнаружить визуально, например, при заражении коронавирусами прекращается движение ворсинок мерцательного эпителия. Использование этого метода позволило выделить много респираторных вирусов, так как некоторые из них вне организма естественного хозяина растут лишь на органных культурах.
3. 4. 3. Первичнотрипсинизированные клеточные культуры
Термином «первичные» обозначают клеточную культуру, полученную непосредственно из тканей животных в эмбриональном или постнатальном периоде. Срок жизни таких культур ограничен. По истечении определенного времени наступает «возрастная» дегенерация клеток — грануляция и вакуолизация цитоплазмы, округление клеток, утрата связи между клетками и твердым субстратом, на котором их выращивалют. Смена среды, ее состава и др. манипуляции могут лишь несколько удлинить срок культивирования, но не могут предотвратить нарушение структуры и гибели клеток.
|
|
|
В основе получения первичнотрипсинизированных клеточных культур лежит обработка кусочков ткани протеолитическими ферментами — трипсином, панкреатином и др., которая приводит к разрушению межклеточных протоплазматических мостиков и расслоению клеточной массы.
Широкое внедрение методики трипсинизации в вирусологическую практику связано с работами Дульбекко и Фогг (1952-1954), которые показали возможность приготовления однослойных культур из тканей куриного эмбриона и почек обезьян. Янгнер (1954) усовершенствовал методику трипсинизации, заменив пипетирование механическим перемешиванием фрагментов ткани в растворе трипсина. В таком виде с незначительными вариантами методика сохранилась до настоящего времени (рис. 6).
Источником получения клеток могут служить органы и ткани эмбрионов, взрослых животных. Они могут быть как нормальными, так и злокачественно перерожденными. Наибольшей потенцией к росту обладают клетки эмбриональных и опухолевых тканей. Легче культивировать от эмбрионов — клетки соединительной ткани, от взрослых животных — эпителиальные.
Выбор клеток для культивирования определяется их чувствительностью in vitro к тому или иному вирусу. Прямой зависимости между восприимчивостью животных in vivo и чувствительностью клеток их тканей in vitro к вирусам не отмечают.
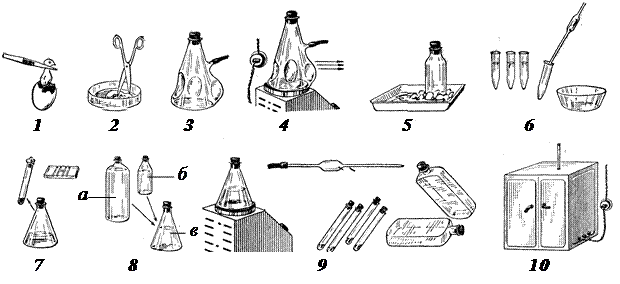
Рис. 6. Схема получения первичнотрипсинизированной культуры:
1. — извлечение эмбриона, 2. — отсечение головы, 3. — промывка, 4. — трипсинизация, 5. — объединение клеточной взвеси в сосуде на таящем люду, 6. — центрифугирование и удаление трипсина, 7. — ресуспендирование в питательной среде и подсчет количества клеток, 8. — доведение до посевной концентрации, 9. — посев клеток при помешивании взвеси, 10. — помещение в термостат при 37º С; а — питательная среда, б — сыворотка, в — взвесь клеток (по Я. Е. Колякову и соавт. ).
Чаще всего в практике для приготовления первичнотрипсинизированной культуры используют почечную ткань, реже — ткани других органов. Исходный материал должен быть получен в асептических условиях и сразу же подвергнут трипсинизации. Если это по каким-то причинам осуществить невозможно, орган можно сохранять б питательном растворе при 4º С в течение 24 часов, в исключительных случаях до 48 часов. Хранение неблагоприятно сказывается на выходе клеток и их качестве.
|
|
|
Для получения культуры используют 7…10-дневные куриные эмбрионы, от которых для трипсинизации берут кожно-мышечный мешок (предварительно удаляют конечности и голову).
Получение культуры производят следующим образом: извлеченные в стерильных условиях почки помещают в чашки Петри, декапсулируют и срезают корковый слой (можно для тринсинизации использовать всю почку после удаления лоханки), а затем измельчают до кусочков размером 1…2 мм и отмывают раствором Хенкса до получения прозрачной жидкости. Измельченную ткань инкубируют в теплом растворе трипсина при 37º С в течение 15…20 мин (срок инкубации зависит от вида используемой ткани). Раствор трипсина заменяют новой порцией (соотношение ткани и трипсина 1: 10…1: 12) и помещают для последующей трипсинизации при 37º Сна магнитную мешалку. Выход клеток можно увеличить при использовании дробной трипсинизации. При этом клеточную суспензию сливают каждый раз через 5…10 мин., а к оставшейся ткани добавляют новую порцию трипсина. Дробную трипсинизацию проводят до полного истощения ткани. Собранную взвесь клеток фильтруют через двуслойный марлевый фильтр, добавляют раствор Хенкса и сыворотку крупного рогатого скота (для уменьшения диспергирующего действия трипсина), а затем центрифугируют 5 мин при 800…1000 об/мин. Надосадочную жидкость сливают, а к осадку добавляют ростовую питательную среду, подогретую до 37º С, тщательно пипетируют и проводят подсчет клеток. Диспергирующее действие трипсина можно также уменьшить, помещая сосуд с клеточной взвесью в тающий лед. Это позволяет объединить все порции клеток и провести центрифугирование один раз.
|
|
|
Подсчет клеток проводят чаще всего в камере Горяева. Точное определение числа клеток необходимо потому, что хороший монослой можно получить лишь при оптимальной посевной дозе. При малой посевной дозе не образуется сплошной монослой даже при длительном культивировании, а при слишком большой — происходит интенсивная пролиферация клеток, что приводит к быстрому их старению и специфической дегенерации.
Клетки можно подсчитывать как после окраски, так и в нативном виде. В первом случае к 1 см3 взвеси клеток в питательной среде добавляют равный объем 0, 1% раствора кристаллического фиолетового, приготовленного на 0, 1 М растворе лимонной кислоты. При этом методе все клетки окрашиваются в темный цвет. После перемешивания камеру заполняют взвесью клеток. Подсчитывают все клетки, имеющие ядро и неповрежденную цитоплазму, а группу клеток с неясными контурами считают за одну. Подсчет производят при увеличении микроскопа: окуляр 7, объектив 20 по всей камере. Из каждой пробы берут не менее четырех образцов, и на основании их подсчета определяют среднее число клеток. Количество клеток в 1 см3 суспензии определяют по формуле:
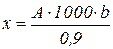 ,
,
где х — число клеток в 1 см3 суспензии; А—среднее число клеток в камере; 0, 9 — объем камеры Горяева, мм3; 1000 — число кубических миллиметров в 1 см3; b — степень разведения
Иногда для упрощения подсчитывают клетки в 5…6 больших квадратах, выводят среднее число клеток на один квадрат и определяют их содержание в 1 см3 взвеси по формуле:
 ,
,
где х — число клеток в 1 см3 суспензии; а — среднее число клеток в большом квадрате; 250 — количество объемов над одним большим квадратом в 1 мм3; 1000 — число мм3 в см3; в — степень разведения взвеси.
При этом также определяют жизнеспособность клеток в суспензии путем окраски 0, 5% водным раствором трипановой сини. В синий цвет окрашиваются только мертвые клетки. Удельный вес (в %) жизнеспособных клеток определяют по формуле:
 ,
,
где x — процент жизнеспособных клеток; N — общее число клеток, L — число мертвых клеток.
Жизнеспособность клеток в первичнотрипсинизированной суспензии колеблется в пределах 60…90 %
В соответствии с результатами подсчета общий объем суспензии доводят ростовой питательной средой рН 6, 9…7, 0 до требуемой концентрации клеток (100000…750000 клеток в 1 см3), и разливают в пробирки, которые помещают в термостат под углом 5…10º или матрасы емкостью 1л — по 100, 1, 5 л — по 200 см3. Для удаления обрывков тканей и эритроцитов, которые тормозят рост клеток, через 48 час производят смену питательной среды рН 7, 2…7, 3. При посеве в матрасы дозу клеток уменьшают вдвое. В матрасы вместимостью 1000, 250 и 100 см3 вносят соответственно по 100, 40 и 15 см3 суспензии, а в пробирки — по 1, 0…1, 5 см3. Новая генерация клеток образует сплошной монослой спустя 3…4 дня после посева, а в матрасах — через 4…5 дней. Клетки хорошо видны под малым увеличением микроскопа.
|
|
|
Субкультуру (вторичная культура тканей) получают из первичнотрипсинизированной после формирования монослоя. Клетки снимают со стенок пробирок или матрасов путем соскабливания или воздействием раствора версена, подвергают трипсинизации и вновь культивируют в другой посуде с новой порцией питательной среды.
Известна более «щадящая» методика трипсинизации, которую используют, в основном, при работе с перевиваемыми культурами клеток.
При этом, в отобранную для пересева однослойную клеточную культуру вносят смесь версена и трипсина, состоящего из 5 см3 2, 5% раствора трипсина разведенного в 100 см3 0, 02% раствора версена. Как только клеточный монослой достаточно разрыхляется и начинает отделяться от стекла, растворы версена и трипсина удаляют пипеткой, а в матрасы после 2…5-минутной выдержки клеточным пластом вверх, во время которого процесс версенизации завершается, заливают определенное количество ростовой среды. Этой средой тщательно смывают клетки со стенок сосуда и пипетируют. Полученную взвесь после подсчета клеток разводят ростовой средой до посевной дозы и используют для получения субкультуры.
Для промышленного производства (получения в условиях биофабрики) А. Н. Курносовым и соавт. (1972) предложен метод перфузионной трипсинизации. Он пригоден для получения клеточной культуры из почек различных видов животных. Имеет ряд преимуществ по сравнению со стандартным методом трипсинизации: более чем в 2 раза увеличивается выход жизнеспособных клеток из 1 г ткани; уменьшает фракцию клеточного детрита; почти в 6…10 раз сокращает расход трипсина; снижает затраты времени на приготовление суспензии клеток.
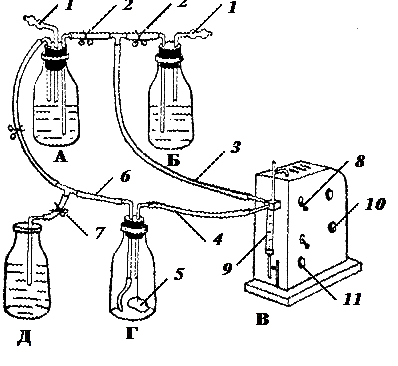
Рис. 7. Рабочая схема проведения перфузионной дезагрегации изолированных почек животных:
А — сосуд с трипсином; Б — сосуд с рабочим раствором Хенкса; В — аппарат для стерильно-дозированного розлива жидкости «Диспенсор»; Г — сосуд с перфузируемой почкой; Д — сосуд для сбора отмывочной жидкости; 1 — воздушные фильтры; 2 — зажимы; 3 — всасывающий трубопровод; 4 — нагнетающий трубопровод; 5 — почка; 6 — возвратный трубопровод; 7 — зажимы на отводящем трубопроводе; 8 — пусковой тумблер; 9 — шприц-дозатор; 10 — регулятор объема подачи раствора; 11 —регулятор скорости (по Д. Ф. Осидзе)
Принципиальным отличием данного метода от стандартного заключается в том, что трипсинизация почечной ткани происходит не в каком-либо сосуде, куда посещают извлеченный орган, измельчают, отмыванию и т. д., а все это проходит непосредственно через артерию внутрь почки путем нагнетания солевого и диспергирующего растворов.
Для этих целей используют набор аппаратов, сосудов и других приспособлений, из которых собирают закрытую систему, сообщающихся сосудов, перечень которых, их компоновка представлены в «Рабочей схеме проведения перфузионной дезагрегации изолированных почек животных» (рис. 7).
Получение клеточной суспензии проводят следующим образом: почку от эмбрионов животных изолируют общепринятым спсобом, затем, не повреждая капсулы и почечной артерии, отпрепаровывают от жирового сальника, отсекая почечную артерию и мочеточник, оставляя культю длиной 1, 5…2 см. После этого в артерию вставляют канюлю, через которую вначале в сосудистую сеть органа нагнетают раствор Хенкса (промывание), а затем — 0, 25% раствор трипсина для дезагрегации ткани. Время перфузии зависит от вида и возраста доноров почки и колеблется в пределах 10…35 мин. Время окончания данной манипуляции определяют по появлению под капсулой определенной многочисленной сети «трещин», что свидетельствует о достаточном разрыхлении паренхимы органа. Затем почки освобождают от капсулы, измельчают на крупные кусочки и дезагрегируют в питательной среде на магнитной мешалке или гомогенизаторе до полного истощения ткани в течение 2…5 мин. Полученную клеточную суспензию фильтруют, подсчитывают число клеток, разбавляют до посевной концентрации и высевают в матрасы (пробирки).
Данный метод является менее травматичным, что способствует более высокому выходу жизнеспособных клеток по сравнению со стандартным методом, более быстрому формированию (на сутки) клеточного монослоя.
|
|
|


