 |
Задачи и упражнения для самостоятельного решения
|
|
|
|
1. Зависимость константы равновесия от температуры выражается уравнением:
 .
.
Найдите производную d ln Kp / dT.
(Ответ:  )
)
2. Рассчитайте изменение энтальпии 1 моля α -SiO2 при нагревании от 331 до 484 К по формуле 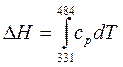 с учетом зависимости теплоемкости от температуры:
с учетом зависимости теплоемкости от температуры:
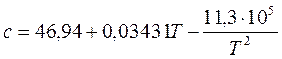 .
.
(Ответ: 10,361 кДж/моль)
3. Реакция омыления метилацетата щелочью при 298 К протекает по уравнению
CH3COOСH3 + NaOH = CH3COONa + CH3OH.
Для этой реакции при 298 К получены следующие результаты:
| № | t, мин | с, моль/л |
| 0,00740 | ||
| 0,00634 | ||
| 0,00550 | ||
| 0,00464 | ||
| 0,00363 | ||
| 0,00254 |
Рассчитайте скорость химической реакции и постройте график зависимости скорости от времени.
(Ответ: 5,3·10–4; 4,2·10–4; 2,86·10–4; 2,02·10–4; 1,09·10–4 ммоль/(л·с))
ФИЗИЧЕСКАЯ ХИМИЯ
МОДУЛЬ 1
ТЕРМОДИНАМИКА. ТЕРМОХИМИЯ
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ. ТЕРМОХИМИЯ
Производство подавляющего большинства лекарственных форм является многостадийным процессом, состоящим из ряда химических реакций. Информация о тепловых эффектах реакций позволяет оптимизировать процесс в целом.
Законы термодинамики являются теоретическим фундаментом, который используется в таких разделах физической и коллоидной химии, как химическая термодинамика, термодинамика фазовых равновесий, термодинамика поверхностных явлений, адсорбция.
Первое начало термодинамики
Основные уравнения
При малых давлениях состояние реального газа приближенно описывается уравнением состояния идеального газа – уравнением Менделеева – Клапейрона:
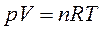 . .
| (22) |
Когда в процессе изменения состояния газа один из параметров состояния p, V или T остается постоянным, удобно применять более частные законы.
|
|
|
Закон Бойля – Мариотта (1661 г.). Объем газа обратно пропорционален давлению при постоянной температуре (Т – const):
 . .
| (23) |
Закон Гей-Люссака (1802 г.). Объем газа пропорционален температуре при постоянном давлении (р – const):
 . .
| (24) |
Закон Шарля (1787 г.). Давление газа пропорционально температуре при постоянном объеме (V – const):
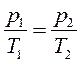 . .
| (25) |
Закон Авогадро (1811 г.). Равные объемы идеальных газов содержат в одинаковых условиях (р и Т) равное число молекул. Объем, занимаемый 1 моль газа, называется молярным объемом. При нормальных условиях (н.у.) р =1 атм и Т =273 К молярный объем равен Vm = 22,4 л.
Объединенный газовый закон.
 . .
| (26) |
Уравнения (22) – (26) связывают между собой параметры газа, находящегося в состоянии 1, с параметрами того же газа, находящегося в состоянии 2.
Работа расширения газа, совершаемая термодинамической системой, равна:
 . .
| (27) |
Если работа совершается системой при постоянном давлении, то уравнение (27) принимает вид:
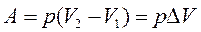
| (28) |
или
| A = nR (T 2 – T 1). | (29) |
если при постоянной температуре, то
 . .
| (30) |
Если объем системы не изменяется, или внешнее давление равно 0 (расширение в вакуум), то A = 0.
Работа, совершаемая в результате протекания химической реакции в том случае, когда при постоянной температуре и давлении в системе изменяется число молей газообразных веществ n (число молей газообразных реагентов не равно числу молей газообразных продуктов), рассчитывается по уравнению, которое следует из уравнения (28):
 , ,
| (31) |
где D n – разность числа молей газообразных продуктов и числа молей газообразных реагентов в уравнении химической реакции.
Первое начало (закон) термодинамики (Майер, 1842 г.). Закон является следствием закона сохранения энергии:
Ø во всех явлениях природы энергия не исчезает бесследно и не возникает из ничего, а лишь превращается из одной формы в другую в строго эквивалентных количествах
или в другой формулировке
|
|
|
Ø в изолированной системе сумма всех видов энергии есть величина постоянная.
Уравнение I закона термодинамики в интегральной форме имеет вид:
| Q = D U + A. | (32) |
а в дифференциальной форме –
| d Q = dU + d A. | (33) |
Для изотермического расширения идеального газа U – const и уравнение принимает вид:
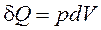
| (34) |
или
| Q = p D V. | (35) |
Внутренняя энергия одноатомного идеального газа равна:
| U = 3/2 nRT. | (36) |
Выражая давление из уравнения (22)
 ,
,
подставляя в уравнение (34) и интегрируя, получим уравнение для расчета количества тепла, которое необходимо затратить для расширения или сжатия газа в изотермических условиях:
 . .
| (37) |
Из уравнения (27) для работы следует, что в изохорном процессе для любого газа работа равна 0; в этих условиях уравнение (32) принимает вид:
| QV = D U. | (38) |
то есть все тепло, подведенное к термодинамической системе, расходуется на изменение ее внутренней энергии.
Для изобарного процесса таким же образом получим уравнение:
| Qр = D Н. | (39) |
Энтальпия и внутренняя энергия термодинамической системы связаны между собой соотношением:
| Н = U + pV. | (40) |
а их изменения в химической реакции –
| D Н = D U + D(pV). | (41) |
В том случае, когда при постоянной температуре и давлении в системе изменяется число молей D n газообразных веществ (например, протекает химическая реакция, в которой число молей газообразных веществ, вступающих в реакцию, не равно числу молей газообразных продуктов), уравнение (41) можно записать в другой форме:
| D Н = D U + D nRT. | (42) |
Для расчета количества тепла, необходимого для нагревания 1 моля веществ, используется средняя мольная теплоемкость (при постоянном давлении или объеме):
 , ,
| (43) |
а также истинная теплоемкость при постоянном давлении:
 , ,
| (44) |
 . .
| (45) |
и при постоянном объеме:
 , ,
| (46) |
 . .
| (47) |
Для газообразных веществ эти теплоемкости связаны друг с другом уравнением:
| Ср – СV = R, | (48) |
причем для одноатомного идеального газа:
| Ср = 5/2 R. | (49) |
|
|
|


