 |
Внутренняя энергия тела. Теплота. Теплоемкость. Физическое состояние вещества, фазовая диаграмма чистого. Теплота - количество энергии, передаваемой от одного тела к другому посредством теплопроводности, конвективного или лучистого теплообмена
|
|
|
|
Внутренняя энергия тела
Внутренняя энергия U представляет собой полный запас энергии термодинамической системы и является функцией состояния, она не зависит от пути процесса, а ее элементарное изменение обозначается символом полного дифференциала (dU).
Внутренняя энергия измеряется в Джоулях (Дж), а удельная внутренняя энергия (u) - в Дж/кг.
Для простых тел внутренняя энергия определяется как функция двух переменных (р, T; р, v или T, v).
Теплота
Теплота - количество энергии, передаваемой от одного тела к другому посредством теплопроводности, конвективного или лучистого теплообмена. Процесс передачи теплоты называется теплообменом.
Количество теплоты  , получаемое телом в результате теплообмена, зависит от вида термодинамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты не является полным дифференциалом (
, получаемое телом в результате теплообмена, зависит от вида термодинамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты не является полным дифференциалом (  ).
).
Количество теплоты  измеряется в Джоулях (Дж), а удельное количество теплоты
измеряется в Джоулях (Дж), а удельное количество теплоты  =
=  /
/ 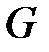 в Дж/кг.
в Дж/кг.
Теплоемкость
Истиной теплоемкостью называется количество теплоты, которое надо сообщить единице количества вещества в термодинамическом процессе (z=idem. ), чтобы его температура повысилась на 1 градус.
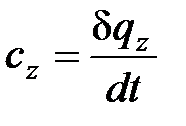 . (1. 15)
. (1. 15)
Различают массовую теплоемкостьс, измеряемую в Дж/(кг× К), молярную  – Дж/(кмоль× К) и объемную с' – Дж/(м3× К).
– Дж/(кмоль× К) и объемную с' – Дж/(м3× К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
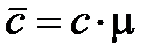 ;
;  . (1. 16)
. (1. 16)
Экспериментальное определение теплоемкости обычно проводится в двух процессах: при постоянном объеме z=v=idem. (изохорная теплоемкость cv ) и постоянном давлении z=p=idem. (изобарная теплоемкость cp).
|
|
|
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Из уравнения (1. 16) следует, что количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
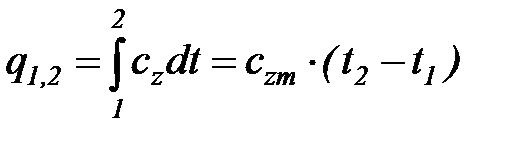 . (1. 17)
. (1. 17)
Отсюда следует выражение средней теплоемкости газа
 . (1. 18)
. (1. 18)
Для большинства газов значения средней теплоемкости в интервале температур от t1 до t2 приведены в специальных термодинамических таблицах.
Для некоторых газов в определенном интервале температур изменение истинной теплоемкости подчиняется линейному закону
 . (1. 19)
. (1. 19)
Подставив это выражение (1. 20) в уравнение (1. 19), получим
 , (1. 20)
, (1. 20)
где сzm - первая средняя теплоемкость. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
Физическое состояние вещества, фазовая диаграмма чистого
вещества
Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
С помощью фазовой диаграммы можно проследить переход тела из одного агрегатного состояния в другое. Рассмотрим диаграмму фазовых состояний чистого вещества (рис. 1. 3).
Линии фазовых превращений (испарение- I, плавление - II,
сублимации - III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
Фазами системы называются области, ограниченные поверхностями раздела. На линиях фазовых превращений существует однозначная зависимость между давлением и температурой. Эти линии пересекаются в тройной точке, где вещество одновременно находится в трех агрегатных состояниях. Параметры тройной точки принадлежат к термодинамическим константам вещества.
|
|
|
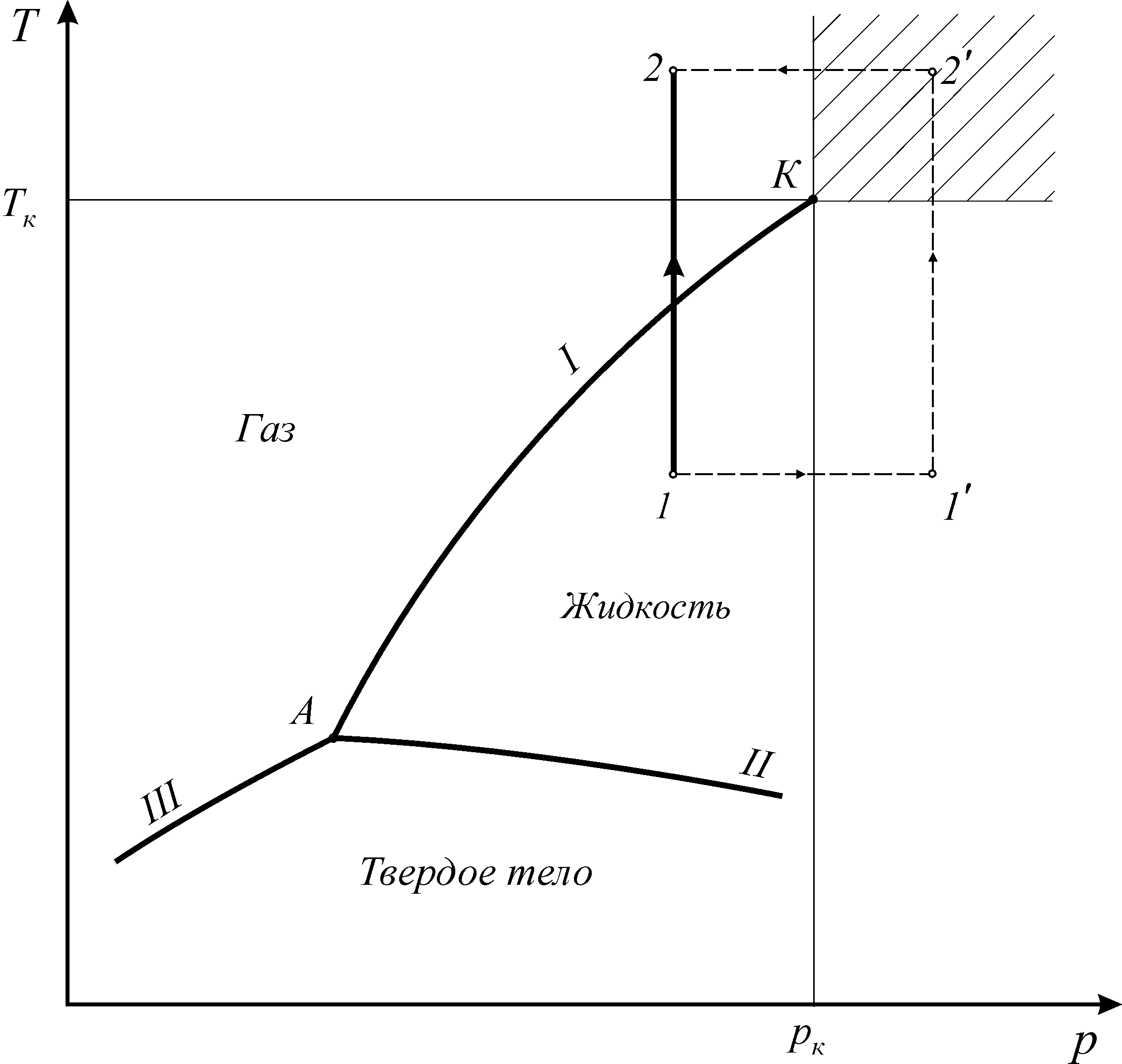
Рис. 1. 3. Диаграмма фазовых состояний чистого вещества
Энергетической границей между жидкостью и паром является теплота испарения, а между твердым телом и жидкостью – теплота плавления.
Фазовые переходы осуществляются изобарно-изотермически с подводом или отводом теплоты. Теплота фазового перехода обозначается символом 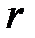 и определяется как разность энтальпий.
и определяется как разность энтальпий.
Наибольший интерес для проведения технических расчетов в термодинамике представляютгаз ижидкость. При увеличении давления и температуры теплота фазового перехода заметно уменьшается и в критической точке исчезает полностью, исчезает термодинамическое различие между жидкостью и газом.
Критические параметры являются термодинамическими постоянными вещества. Критическая температура 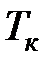 – это температура, при которой и выше которой газ никаким сжатием не может быть переведен в жидкое состояние. Критическое давление
– это температура, при которой и выше которой газ никаким сжатием не может быть переведен в жидкое состояние. Критическое давление 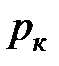 – это давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние.
– это давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние.
В закритической области (  ) вещество может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии
) вещество может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии 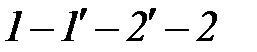 (рис. 1. 3).
(рис. 1. 3).
Условным признаком непрерывности однофазного состояния вещества является возможность перехода его из любого однофазного исходного состояния в другое однофазное состояние путем непрерывных изменений параметров состояния, минуя фазовые энергетические барьеры.
Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния 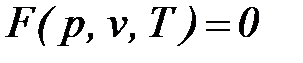 , описывающее любое однофазное состояние вещества. Точных термодинамических уравнений состояния в настоящее время нет. Известны точные уравнения лишь для предельных состояний идеальных газов и несжимаемых тел.
, описывающее любое однофазное состояние вещества. Точных термодинамических уравнений состояния в настоящее время нет. Известны точные уравнения лишь для предельных состояний идеальных газов и несжимаемых тел.
|
|
|
|
|
|


