 |
Аналитическое выражение первого начала термодинамики
|
|
|
|
Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
 ; (12)
; (12)
 . (13)
. (13)
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
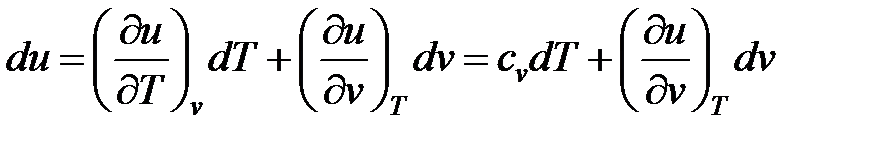 ; (14)
; (14)
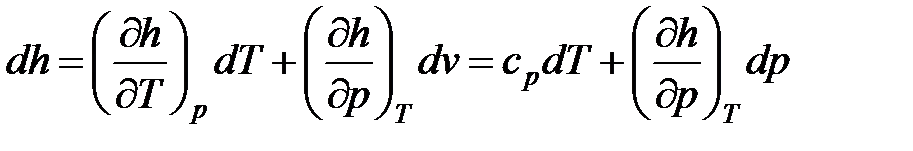 . (15)
. (15)
Соотношения (14) и (15) получены, исходя из анализа зависимостей, который показывает, что для изохорного процесса (  ) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости
) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости
 , (16)
, (16)
а для изобарного процесса (  ) частная производная энтальпии по температуре равна истинной изобарной теплоемкости
) частная производная энтальпии по температуре равна истинной изобарной теплоемкости
 . (17)
. (17)
В результате подстановки выражений (16) и (17) в уравнения (14, 15) и разделения переменных получим:
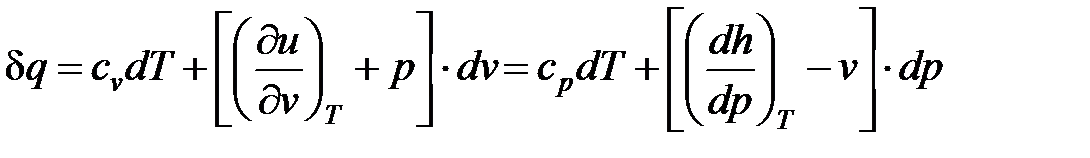 . (18)
. (18)
Выражения в квадратных скобках уравнения (18) в литературе часто называют калорическими коэффициентами, которые могут быть определены по формулам, полученным с использованием дифференциальных соотношений термодинамики,
hv =  , (19)
, (19)
hp = 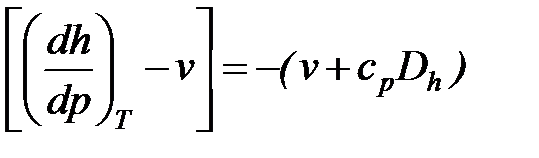 , (20)
, (20)
где  – коэффициент Джоуля – Гей Люссака,
– коэффициент Джоуля – Гей Люссака,
 ; (21)
; (21)
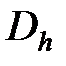 – коэффициент Джоуля-Томсона,
– коэффициент Джоуля-Томсона,
 . (22)
. (22)
Коэффициенты Джоуля – Гей Люссака (  ) и Джоуля-Томсона (
) и Джоуля-Томсона (  ) реальных газов определяются по таблицам термодинамических свойств, представленным в справочной литературе.
) реальных газов определяются по таблицам термодинамических свойств, представленным в справочной литературе.
|
|
|
Данное соотношение (18) называется первым началом термодинамики для простых тел в аналитической форме.
Первое начало термодинамики для идеальных газов.
Закон Майера. Энтропия идеального газа
Идеальные газы подчиняются уравнению состояния Клапейрона 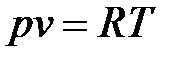 и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
 . (23)
. (23)
Совместное использование уравнения Клапейрона и закона Джоуля приводит к выводу о том, что удельная энтальпия идеального газа также являются функциями только температуры
 . (24)
. (24)
С учетом законов идеальных газов и исходя из соотношений (14, 15), изменение внутренней энергии 1 кг идеального газа в элементарном и конечном (1-2) процессах находится по следующим формулам:
 ;
;  , (25)
, (25)
а изменение энтальпии 1 кг идеального газа в элементарном и конечном
(1-2) процессах определяется по следующим зависимостям:
 ;
;  . (26)
. (26)
После подстановки соотношений (25) и (26) в выражение первого начала термодинамики для простых тел (10, 11) получаем уравнение первого начала термодинамики для идеального газа по балансу рабочего тела в дифференциальной и интегральной формах:
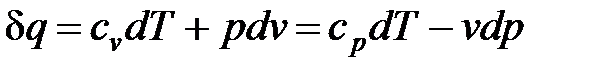 ; (27)
; (27)
 . . (28)
. . (28)
Из уравнения первого начала термодинамики для идеального газа (28) можно получить следующее выражение:
 , (29)
, (29)
из которого следует, что разность истинных теплоемкостей идеального газа при постоянном давлении и при постоянном объеме равна величине характеристической газовой постоянной
|
|
|
 . (30)
. (30)
Это выражение (30) впервые было получено Р. Майером (1842 г. ) и называется законом Майера.
Уравнение (30) может быть записано и для одного кмоля газа
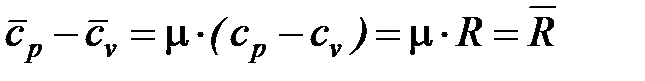 . (31)
. (31)
Разделив уравнение (27) на абсолютную температуру T, получим
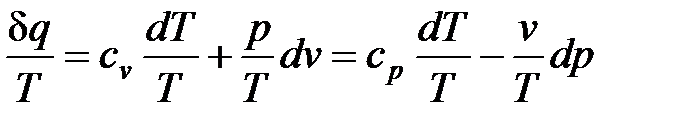 . (32)
. (32)
С учетом того, что для идеального газа, исходя из уравнения
Клапейрона, справедливы равенства:  ;
;  получим
получим
 . (33)
. (33)
Правая часть уравнения (33) представляет собой сумму полных дифференциалов. Это значит, что и соотношение  есть полный дифференциал некоторой функции состояния идеального газа(s), называемой удельной энтропией.
есть полный дифференциал некоторой функции состояния идеального газа(s), называемой удельной энтропией.
Изменение удельной энтропии в элементарном процессе представляет собой полный дифференциал и определяется соотношением
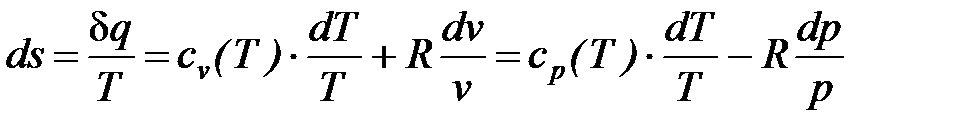 (34)
(34)
Из уравнения (34) после интегрирования получим, что изменение удельной энтропии идеального газа в процессе (1-2) может быть найдено из соотношения
 =
= 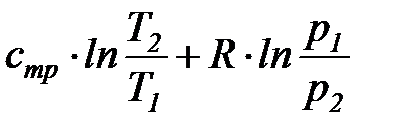 . (35)
. (35)
Теплоемкости  и
и  называются вторыми средними теплоемкостями и находятся путем осреднения по логарифму абсолютных температур
называются вторыми средними теплоемкостями и находятся путем осреднения по логарифму абсолютных температур
 . (36)
. (36)
Если принять, что истинная теплоемкость является линейной функцией температуры  , то
, то
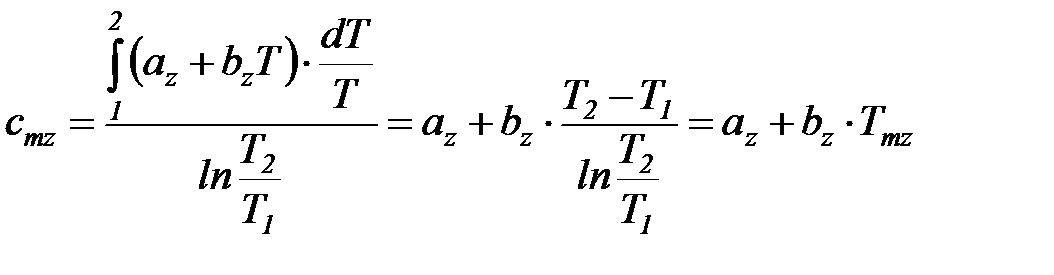 . (37)
. (37)
Таким образом, первая средняя теплоемкость равна истинной теплоемкости при средней арифметической температуре процесса (Tma ), а вторая – при средней логарифмической температуре процесса (Tmz). В случае, если  , то первая средняя теплоемкость численно несколько больше второй.
, то первая средняя теплоемкость численно несколько больше второй.
Процессы изменения состояния термодинамических систем
|
|
|


