 |
Схемы смешения. Смеси идеальных газов
|
|
|
|
Схемы смешения
При образовании смесей на практике встречаются две основные схемы смешения: при постоянном объеме (V = idem, рис. 1. 20а) и постоянном давлении (p = idem, рис. 1. 20б).
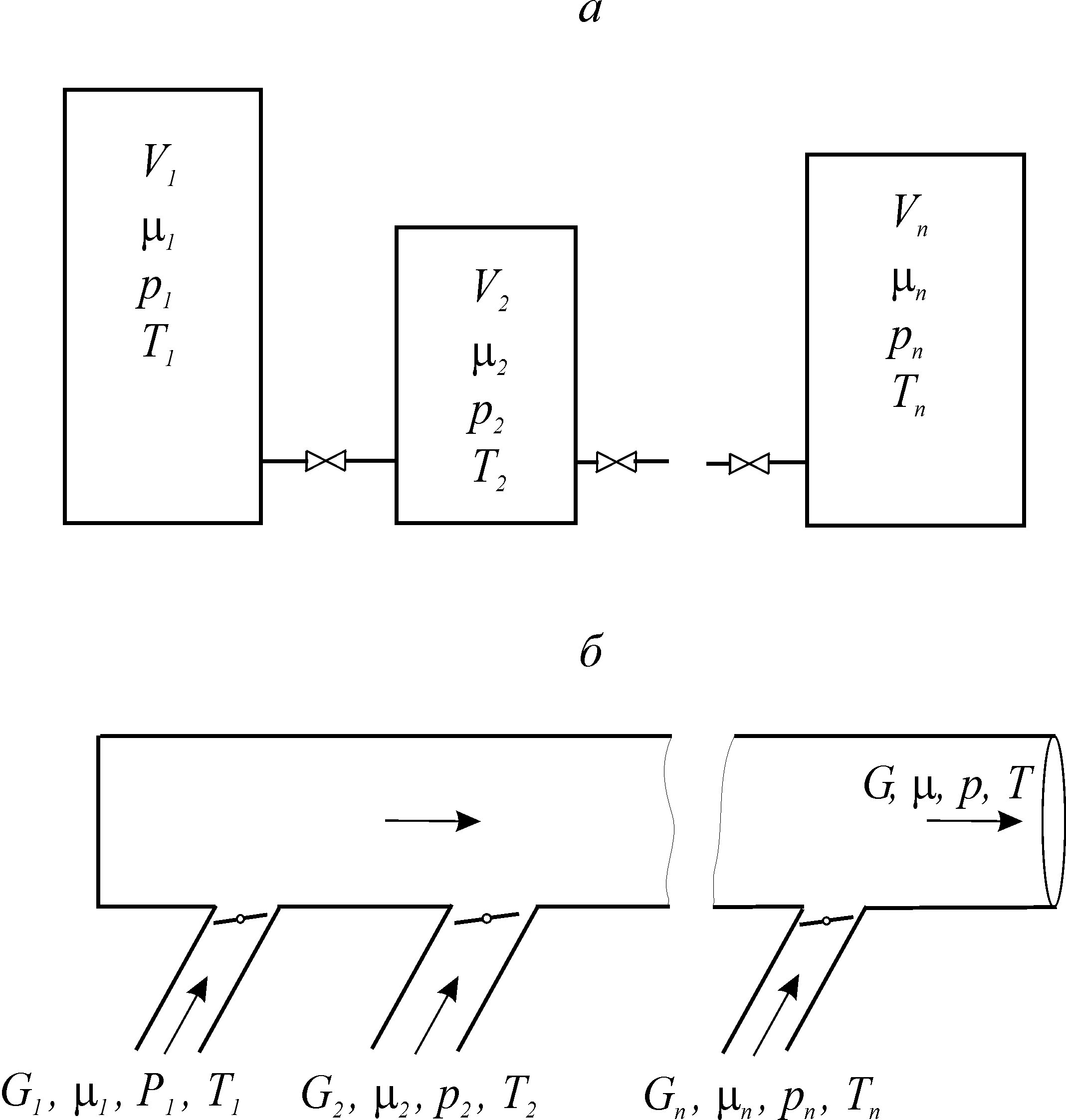
Рис. 1. 20. Схемы смешения при постоянном объеме (а)
и при постоянном давлении (б)
При расчете и анализе схемы смешения при постоянном объеме рассматривается система, включающая ряд резервуаров, соединенных трубопроводами с установленными на них кранами (рис. 1. 20а). В каждом резервуаре
объемом Vi находится один компонент с известными исходными
параметрами (Gi,  ,
,  , Ti ). После открытия кранов во всех резервуарах происходит выравнивание давления pm, а затем температуры Tm и концентрации компонентов (mi, ri) – система переходит в состояние термодинамического равновесия. Во всех стадиях процесса смешения полный объем системы сохраняет неизменную величину V =
, Ti ). После открытия кранов во всех резервуарах происходит выравнивание давления pm, а затем температуры Tm и концентрации компонентов (mi, ri) – система переходит в состояние термодинамического равновесия. Во всех стадиях процесса смешения полный объем системы сохраняет неизменную величину V =  .
.
В процессе смешения по схеме с постоянным объемом теплота извне не подводится (  ) и внешняя работа не совершается (
) и внешняя работа не совершается (  ) и, следовательно, исходя из первого начала термодинамики по внешнему балансу (1. 35), получаем, что этот процесс смешения идет без изменения внутренней энергии
) и, следовательно, исходя из первого начала термодинамики по внешнему балансу (1. 35), получаем, что этот процесс смешения идет без изменения внутренней энергии
 (
(  ). (1. 198)
). (1. 198)
Смесеобразование при постоянном давлении происходит в трубопроводах (рис. 1. 20б). К общему трубопроводу отдельными потоками подводятся компоненты. Для каждого компонента известны: массовый расход Gi, молярная масса mi , давление pi и температура Ti . Смесеобразование в трубопроводе возможно лишь в случае, когда давление каждого компонента pi больше среднего давления смеси в трубопроводе  . При прохождении запорного устройства давление компонента уменьшается до среднего давления смеси
. При прохождении запорного устройства давление компонента уменьшается до среднего давления смеси  – отсюда наименование схемы (
– отсюда наименование схемы ( 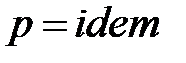 ).
).
|
|
|
Заключительные стадии процесса смешения при 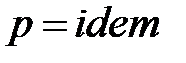 – выравнивание температур, концентраций компонентов в смеси (диффузионные процессы) и переход системы в состояние термодинамического равновесия.
– выравнивание температур, концентраций компонентов в смеси (диффузионные процессы) и переход системы в состояние термодинамического равновесия.
В процессе смешения при 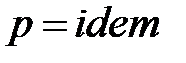 теплота извне не подводится (
теплота извне не подводится (  ) и внешняя работа не совершается (
) и внешняя работа не совершается ( 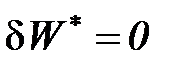 ) и, следовательно, исходя из первого начала термодинамики по внешнему балансу для потока (81), получаем, что этот процесс смешения идет без изменения энтальпии
) и, следовательно, исходя из первого начала термодинамики по внешнему балансу для потока (81), получаем, что этот процесс смешения идет без изменения энтальпии
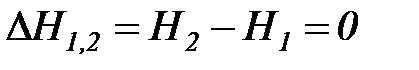 (
(  ). (1. 199)
). (1. 199)
Смеси идеальных газов
Смеси идеальных газов являются также идеальными газами и подчиняются уравнению состояния идеальных газов (уравнению Клапейрона)
 , (1. 200)
, (1. 200)
где  ,
,  – давление и температура смеси.
– давление и температура смеси.
Средняя температура и среднее давление смеси характеризуют конечное состояние диффузионного равновесия смеси.
Состояние компонентов смеси в процессе перемешивания непрерывно изменяется, начиная с момента первичного выравнивания давлений компонентов и кончая состоянием диффузионного равновесия, когда давление каждого из компонентов снижается до уровня стабильного парциального давления  .
.
Закон диффузионного равновесия смеси идеальных газов (закон Дальтона) характеризует установившееся состояние газовой смеси и формулируется следующим образом: каждый компонент смеси ведет себя в газовой смеси так, как будто он один при температуре смеси  равномерно распространен во всем объеме смеси
равномерно распространен во всем объеме смеси  и развивает при этом давление, которое называется парциальным
и развивает при этом давление, которое называется парциальным  .
.
Уравнения состояния для i-го компонента и всей смеси идеальных газов могут быть представлены в следующем виде:
 =
= 
 ; (1. 201)
; (1. 201)
 . (202)
. (202)
При делении уравнения (1. 201) на уравнение (1. 202) получаем
|
|
|
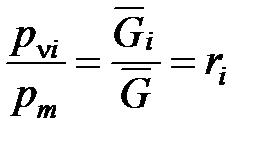 . (1. 203)
. (1. 203)
Из соотношения (1. 203) следует, что парциальное давление i-го компонента 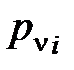 в смеси идеальных газов определяется через полное давление смеси
в смеси идеальных газов определяется через полное давление смеси  и молярную концентрацию компонента
и молярную концентрацию компонента 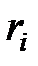
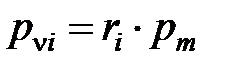 . (1. 204)
. (1. 204)
После преобразования соотношения (1. 204) получаем, что сумма парциальных давлений всех компонентов смеси идеальных газов равна полному давлению смеси
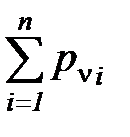 =
= 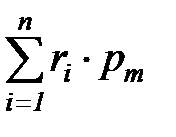 =
=  =
= 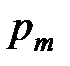 . (1. 205)
. (1. 205)
Поскольку внутренняя энергия и энтальпия идеального газа - функции только температуры, исходными соотношениями для определения средней температуры смеси идеальных газов  служат следующие соотношения:
служат следующие соотношения:
в схеме смешения при 
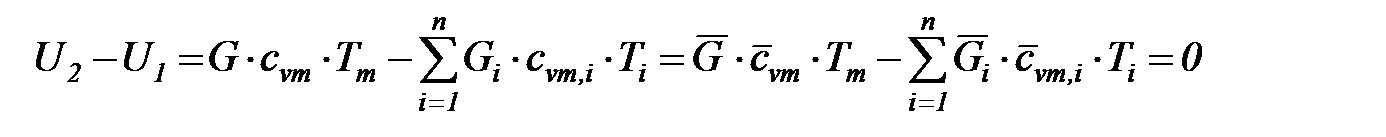 ; (1. 206)
; (1. 206)
в схеме смешения при 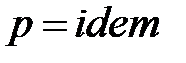
 . (1. 207)
. (1. 207)
С учетом этих соотношений (1. 206), (1. 207) получаем обобщенное выражение по определению средней температуры смеси идеальных газов  для различных схем смешения
для различных схем смешения
 , (1. 208)
, (1. 208)
где 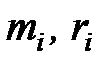 – массовая и молярная концентрации i-го компонента смеси;
– массовая и молярная концентрации i-го компонента смеси;  – средние удельные массовая и молярная теплоемкости i-го компонента смеси в процессах
– средние удельные массовая и молярная теплоемкости i-го компонента смеси в процессах  (
( 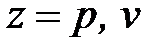 );
);  – средние удельные массовая и молярная теплоемкости смеси,
– средние удельные массовая и молярная теплоемкости смеси,
 , (1. 209)
, (1. 209)
 . (1. 210)
. (1. 210)
Объемная концентрация каждого компонента в смеси  определяется как отношение приведенного объема vi, пр компонента при давлении и температуресмеси к объему всей смеси v при тех же условиях
определяется как отношение приведенного объема vi, пр компонента при давлении и температуресмеси к объему всей смеси v при тех же условиях
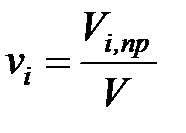 . (1. 211)
. (1. 211)
Для идеального газа, исходя из уравнения состояния
vi, пр =  , v =
, v =  . (1. 212)
. (1. 212)
После подстановки vi, пр и V в соотношение (1. 211) получаем
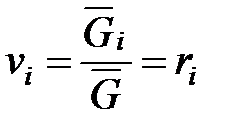 . (1. 213)
. (1. 213)
Отсюда следует, что для смесей идеальных газов объемная и молярная концентрации компонентов численно равны.
|
|
|


