 |
Смеси реальных газов. Первое начало термодинамики
|
|
|
|
Смеси реальных газов
Для расчетов характеристик смесей реальных газов обычно используется следующее уравнение состояния
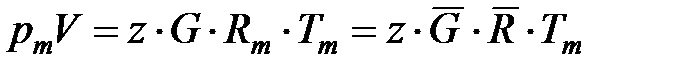 . (1. 214)
. (1. 214)
Определение значений коэффициента сжимаемости z для реальных газовых смесей проводится с использованием закона соответственных состояний. Однако, в отличие от чистых газов, характеристики соответственных состояний определяются не по фактическим критическим параметрам, а по значениям приведенных критических (псевдокритиеских) давления pпк и температуры Tпк газовых смесей:
 ;
; 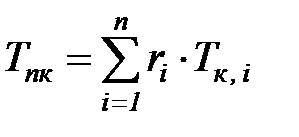 , (1. 215)
, (1. 215)
где pк, i и Тк, i - критические давление и температура компонентов газовой смеси.
Псевдокритические параметры используются для вычисления значений приведенного давлений p и температур t смеси:
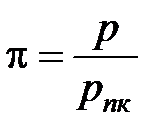 ;
;  . (1. 216)
. (1. 216)
Первое начало термодинамики
Первое начало термодинамики является математическим выражением закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «внутренняя энергия изолированной системы остается неизменной при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
При построении термодинамики принимается, что все возможные энергетические взаимодействия между телами сводятся лишь к передаче теплоты и работы.
В силу того, что теплообмен и передача работы являются единственными формами передачи энергии изменение энергии изолированной системы (т. е. системы, которая энергетический не взаимодействует с окружающей средой или с другой системой) равно нулю duиз=0.
|
|
|
Рассмотрим систему к которой извне подводится или отводится теплота и подводится или отводится термодинамическая работа. В этом случае изменение внутренней энергии системы равно алгебраической сумме подведенных извне теплоты и термодинамической работы (подведенная теплота - положительна, подведенная работа - отрицательна).
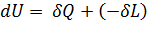 ,
,  . (1)
. (1)
Окончательно исходное выражение первого начала термодинамики формулируется следующим образом: «количество теплоты, подведенное к системе из вне (Q1, 2), идет на изменение внутренней энергии системы и на выполнение работы ( 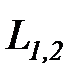 )
)
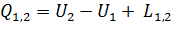 (2)
(2)
В дифференциальной форме уравнение (2, ) может быть представлено следующим образом:
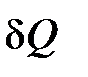 =
=  +
+ 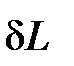 . (3)
. (3)
Уравнения (1. ), (2. ), (3) являются математическим выражением первого начала термодинамики справедливое для обратимых процессов и учитывает только внешние эффекты.
Эффективная работа реального процесса 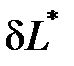 равна разности обратимой работы
равна разности обратимой работы  и работы необратимых потерь
и работы необратимых потерь 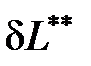 (
( 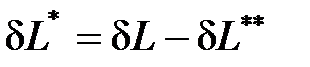 ). Необратимые потери термодинамической работы (
). Необратимые потери термодинамической работы (  ) превращается в теплоту внутреннего теплообмена (
) превращается в теплоту внутреннего теплообмена (  ).
).
Следовательно, в случае реальных процессов, уравнение первого начала термодинамики примет вид
 =
=  +
+ 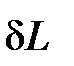
 или
или  =
= 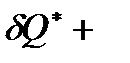
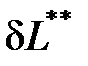 =
= 
 =
=  +
+ 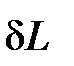 (4а);
(4а); 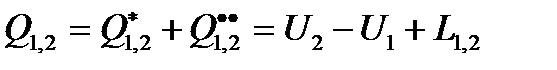 , (4б)
, (4б)
Уравнения (4а) и (4б) называются уравнениями первого начала термодинамики по балансу рабочего тела, и они справедливы для реальных процессов.
В обратимых процессах  =
=  = 0 и уравнения первого начала термодинамики по внешнему балансу и по балансу рабочего тела совпадают.
= 0 и уравнения первого начала термодинамики по внешнему балансу и по балансу рабочего тела совпадают.
Для простых тел, то есть систем, состояние которых определяется двумя независимыми переменными, математическое выражение первого начала термодинамики в дифференциальной форме имеет следующий вид:
|
|
|
для термодинамической системы
 ; (5)
; (5)
для 1 кг системы
 . (6)
. (6)
Выражение удельной потенциальной работы можно представить в виде соотношения
 , (7)
, (7)
из которого следует, что
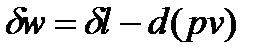 ;
;  . (8)
. (8)
После подстановки выражения  (8) в уравнение (6), получим:
(8) в уравнение (6), получим:
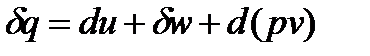 ,
,  . (9)
. (9)
Сумма удельной внутренней энергии (  ) и потенциальной
) и потенциальной
функции ( 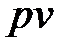 ) называется удельной энтальпией (
) называется удельной энтальпией (  ) (Дж/кг).
) (Дж/кг).
Поскольку энтальпия определяется с помощью параметров состояния (u, р, v), то она является функцией состояния и для простого тела может быть представлена в функции любых двух параметров, например, р и Т. Дифференциал функции состояния является полным дифференциалом.
Подобно полной внутренней энергии энтальпия системы является экстенсивным параметром, зависит от количества вещества и определяется по соотношению 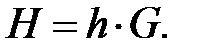
Математическое выражение первого начала термодинамики для простого тела в дифференциальной и интегральной форме имеет следующий вид:
 ; (10)
; (10)
 . (11)
. (11)
Первое начало термодинамики для 1 кг простого тела для реальных систем
( первое начало термодинамики по балансу рабочего тела) в дифференциальной и интегральной форме можно представить в следующем виде:
 . (11а)
. (11а)
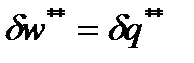 . (11б)
. (11б)
В обратимых процессах  и поэтому выражение первого начала термодинамики совпадает с выражением первого начала термодинамики по балансу рабочего тела.
и поэтому выражение первого начала термодинамики совпадает с выражением первого начала термодинамики по балансу рабочего тела.
|
|
|


