 |
Процессы изменения состояния идеального газа
|
|
|
|
Процессы изменения состояния идеального газа
При изучении процессов изменения состояния идеальных газов, наряду с общими соотношениями по расчету термодинамических
процессов (1. 67) – (1. 113), следует использовать уравнение Клапейрона (1. 23)
и закон Джоуля (1. 51), в соответствии с которыми для идеального газа справедливы следующие выражения:
если  , то
, то  ; (1. 114)
; (1. 114)
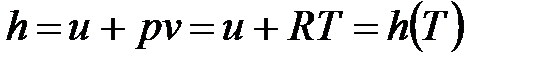 ; (1. 115)
; (1. 115)
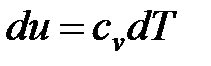 ; (1. 116)
; (1. 116)
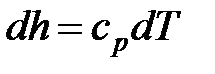 . (1. 117)
. (1. 117)
Из уравнений (1. 114)¸ (1. 117) следует, что для идеального газа процессы изопотенциальный (pv =idem), изотермический (T = idem), изоэнергетический (u= idem) и изоэнталыпийный (h = idem) тождественны и, следовательно, показатели этих процеcсов равны
 . (1. 118)
. (1. 118)
Характеристика расширения или сжатия процессов, в которых рабочим телом является идеальный газ, с учетом уравнения Клапейрона может быть определена по соотношению температур
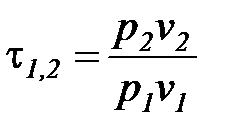 =
=  . (1. 119)
. (1. 119)
Изменения удельных значений внутренней энергии и энтальпии идеального газа в процессе в соответствии с законом Джоуля находится по следующим формулам:
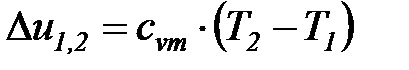 ; (1. 120)
; (1. 120)
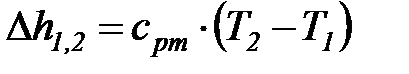 . (1. 121)
. (1. 121)
Показатель адиабатного процесса для идеального газа определяется как соотношение изобарной и изохорной теплоемкостей
k = ns = 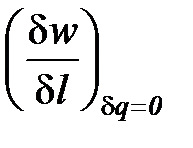 =
=  =
= 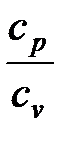 =
= 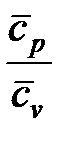 . (1. 122)
. (1. 122)
На основании закона Майера ( 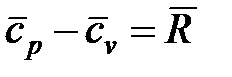 ) показатель адиабаты для идеального газа может быть определен из следующего соотношения:
) показатель адиабаты для идеального газа может быть определен из следующего соотношения:
k = 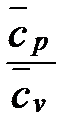 =
=  > 1. (1. 123)
> 1. (1. 123)
|
|
|
Для идеального газа показатель изоэнергетического процесса 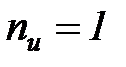 и поэтому удельное количество теплоты в элементарном процессе может быть определено по формуле
и поэтому удельное количество теплоты в элементарном процессе может быть определено по формуле
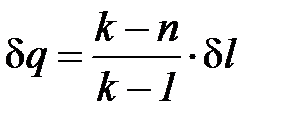 . (1. 124)
. (1. 124)
На примере идеального газа произведем анализ термодинамических процессов (рис. 1. 9).
Адиабата (  ) является линией перемены знака теплообмена. При расширении газа термодинамическая работа
) является линией перемены знака теплообмена. При расширении газа термодинамическая работа 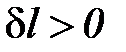 и тогда любая политропа, расположенная правее адиабаты (n < k), находится в области подвода теплоты (
и тогда любая политропа, расположенная правее адиабаты (n < k), находится в области подвода теплоты (  q > 0). Если политропа расширения будет находиться слева от адиабаты (n > k), то этот процесс будет характеризоваться отводом теплоты (
q > 0). Если политропа расширения будет находиться слева от адиабаты (n > k), то этот процесс будет характеризоваться отводом теплоты (  q < 0).
q < 0).
Таким образом, все термодинамические процессы, проходящие выше адиабаты осуществляются с подводом теплоты и наоборот.
Пары и парообразование
Процесс парообразования. Основные определения
При анализе режимов работы теплосиловых установок практически всегда приходиться иметь дело с разного рода жидкостями и их парами.
Процесс парообразования и методика определения основных характеристик процесса парообразования для всех жидкостей практически аналогичны, что дает возможность рассматривать процесс парообразования на примере воды, как одного из наиболее распространенных веществ в природе.
Рассмотрим изобарный процесс парообразования 1 кг воды в
координатах р – v (рис. 1. 21).
В исходном состоянии (  ) вода представляет из себя недогретую жидкость, имеет температуру (
) вода представляет из себя недогретую жидкость, имеет температуру (  ), значение которой ниже температуры насыщения (
), значение которой ниже температуры насыщения ( 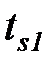 ), а давление воды в этой точке равно р1. В результате изобарного подвода теплоты в процессе (
), а давление воды в этой точке равно р1. В результате изобарного подвода теплоты в процессе (  -
- 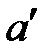 ) вода нагревается до температуры насыщения ts1 и в токе (
) вода нагревается до температуры насыщения ts1 и в токе ( 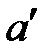 ) начинается процесс кипения.
) начинается процесс кипения.

Рис. 1. 21. Диаграмма состояний водяного пара в координатах p-v
Процесс кипения протекает на участке а'- а" при постоянном давлении р1 и постоянной температуре ts1. В точке (а" ) вода полностью испаряется. Пар в этом состоянии называется сухим насыщенным. На участке (а'-а" ) вода находится в двух фазах и состоит из смеси кипящей воды и сухого насыщенного пара. Эта двухфазная равновесная система называется влажным насыщенным паром. При дальнейшем изобарном подводе теплоты сухой насыщенный пар превращается в перегретый (а). Перегретый пар имеет температуру выше температуры кипения (насыщения) при данном давлении. В состоянии (а) параметры перегретого пара имеют следующие
значения: р1, tа > ts1, va.
|
|
|
Аналогичные процессы изобарного подвода теплоты к воде можно провести при других давлениях р2, р3, и т. д. Соответствующие процессы изображаются линиями b0 -b'-b" -b и с0- с'-с" -с. Точки, характеризующие состояния кипящей воды и сухого насыщенного пара при различных давлениях, соединяются плавными линиями.
Линия a'-b'-с' показывает зависимость удельного объема кипящей воды от давления насыщения  = f(p). Эта линия называется нижней пограничной кривой.
= f(p). Эта линия называется нижней пограничной кривой.
Точки на линии a" -b" -с" характеризуют состояние сухого насыщенного пара, а кривая определяет зависимость удельного объема сухого пара от давления  = f(p) и называется верхней пограничной кривой. Пограничные кривые пересекаются в точке (К), называемой критической.
= f(p) и называется верхней пограничной кривой. Пограничные кривые пересекаются в точке (К), называемой критической.
Параметры и функции состояния кипящей воды на нижней пограничной кривой линии насыщения обозначаются одним штрихом, а сухого насыщенного пара - двумя штрихами. Для однозначного определения состояния кипящей воды и сухого насыщенного пара достаточно знание давления р или температуры насыщения ts, по значению которых в термодинамических таблицах водяного пара можно найти свойства кипящей воды - v', u', h', s' и сухого насыщенного пара - v", u", h", s" .
В области между пограничными кривыми находится влажный насыщенный пар. Каждой температуре насыщенного пара соответствует определенное давление, то есть между этими параметрами существует однозначная зависимость 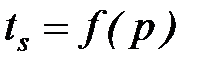 .
.
Для характеристики влажного насыщенного пара, помимо р или ts, в качестве второй независимой переменной используется массовая концентрация сухого насыщенного пара в смеси, называемая степенью сухости или паросодержанием ( 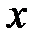 )
)
|
|
|
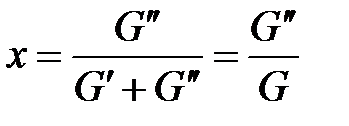 , (1. 217)
, (1. 217)
где G" – масса сухого насыщенного пара;  – масса кипящей жидкости;
– масса кипящей жидкости;
G – масса влажного насыщенного пара.
На нижней пограничной кривой 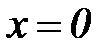 , а на верхней
, а на верхней 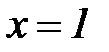 .
.
Отношение массы кипящей жидкости к массе смеси (влажного насыщенного пара) называется влагосодержанием
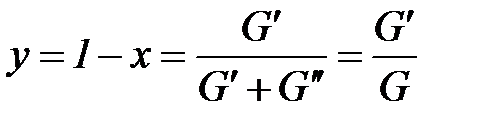 . (1. 218)
. (1. 218)
Количество теплоты, которое необходимо подвести при постоянном давлении к 1 кг кипящей жидкости для превращения ее в сухой насыщенный пар, называется скрытой теплотой парообразования и обозначается символом r . Значение скрытой теплоты парообразования (r) можно определить из математического выражения первого начала термодинамики
 . (1. 219)
. (1. 219)
Так как процесс парообразования протекает при постоянном давлении (  ), скрытая теплота парообразования может быть определена из следующего соотношения:
), скрытая теплота парообразования может быть определена из следующего соотношения:
 . (1. 220)
. (1. 220)
С ростом давления или температуры кипения (насыщения) жидкостей величина скрытой теплоты парообразования 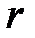 уменьшается и в критической точке становятся равными нулю.
уменьшается и в критической точке становятся равными нулю.
Свойства влажного насыщенного и перегретого пара
Влажный насыщенный пар является бинарной смесью. Свойства влажного насыщенного пара зависят от давления, при котором он находится, от концентраций жидкой и парообразной фаз в системе, которые определяются значением паросодержания  .
.
Известно, что объем  , внутренняя энергия
, внутренняя энергия 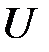 , энтальпия
, энтальпия 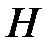 и энтропия
и энтропия  системы являются экстенсивными функциями, значения которых зависят от массы вещества (
системы являются экстенсивными функциями, значения которых зависят от массы вещества ( 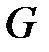 ). Обозначим любую экстенсивную функцию
). Обозначим любую экстенсивную функцию  , а ее удельное значение
, а ее удельное значение  . Тогда
. Тогда  .
.
Для вычисления экстенсивной характеристики системы - влажного насыщенного пара, воспользуемся правилом аддитивности
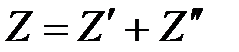 , (1. 221)
, (1. 221)
где 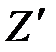 и
и  – экстенсивные характеристики кипящей воды и сухого насыщенного пара.
– экстенсивные характеристики кипящей воды и сухого насыщенного пара.
Выразим экстенсивные характеристики через соответствующие удельные величины и после их подстановки в уравнение (1221) получим
|
|
|
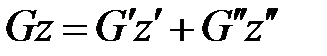 . (1. 222)
. (1. 222)
Разделим члены уравнения (1. 222) на массу влажного насыщенного пара 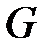 и, с учетом соотношений (1. 217), (1. 218), получим выражение для определения удельных значений характеристик влажного насыщенного пара
и, с учетом соотношений (1. 217), (1. 218), получим выражение для определения удельных значений характеристик влажного насыщенного пара
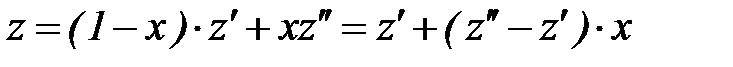 . (1. 223)
. (1. 223)
С помощью соотношения (1. 223) можно записать соотношения для определения основных параметров и удельных значений функций состояния влажного насыщенного пара (удельного объема, внутренней энергии, энтальпии и энтропии):
 ; (1. 224)
; (1. 224)
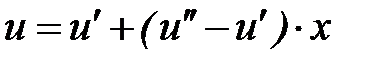 ; (1. 225)
; (1. 225)
 ; (1. 226)
; (1. 226)
 . (1. 227)
. (1. 227)
Энтальпия, энтропия и внутренняя энергия перегретого пара определяются из уравнений приращения этих параметров в изобарическом процессе перегрева. В связи с тем, что перегретый пар по своим свойствам близок к идеальному газу, для изобарного процесса перегрева сухого насыщенного пара с некоторой долей приближения справедливы следующие соотношения:
 ;
;  . (1. 228)
. (1. 228)
После интегрирования соотношений (1. 228) от температуры насыщения Тs до температуры перегретого пара Т, получаем систему выражений для определения удельных значений функций состояния перегретого пара:
 ; (1. 229)
; (1. 229)
 ; (1. 230)
; (1. 230)
 , (1. 231)
, (1. 231)
где  ,
,  – удельные значения энтальпии и энтропии сухого насыщенного пара; сpm,
– удельные значения энтальпии и энтропии сухого насыщенного пара; сpm,  – первая и вторая средние удельные теплоемкости перегретого пара в интервале температур Т-Тs; v – удельный объем перегретого пара;
– первая и вторая средние удельные теплоемкости перегретого пара в интервале температур Т-Тs; v – удельный объем перегретого пара;
 – степень перегрева.
– степень перегрева.
Область перегретого пара заключена между критической изобарой и верхней пограничной кривой (  ) (рис. 1. 22).
) (рис. 1. 22).
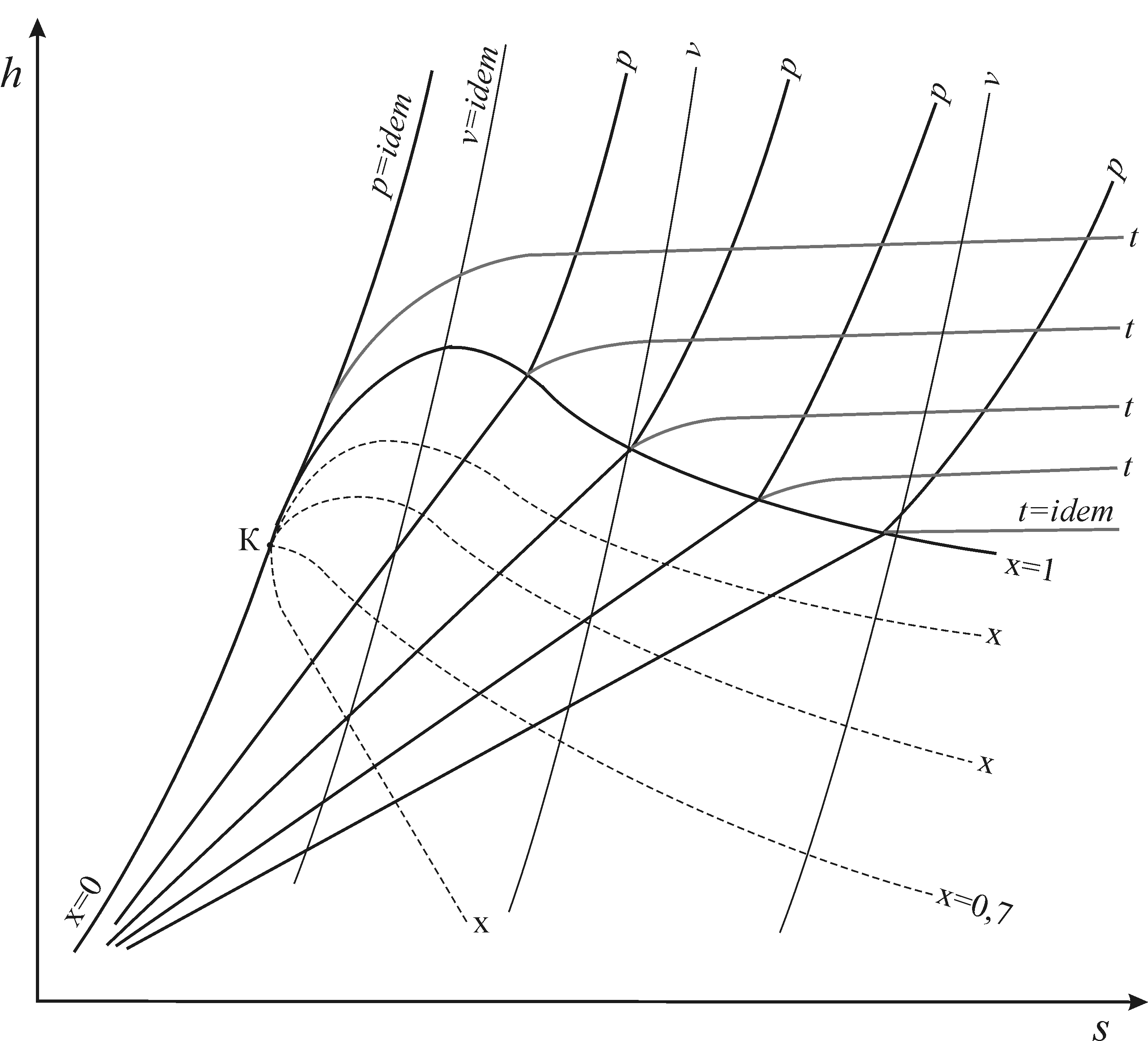
Рис. 1. 22. Диаграмма состояния h-s водяного пара
Характеристики перегретых паров различных веществ v, h, s, u, сp и сv приводятся в термодинамических таблицах водяного пара в функции от давления и температуры.
При проведении термодинамических расчетов, наряду с аналитическими методами, достаточно часто используются и графические методы расчета, проводимые с использованием энтропийных диаграмм (Т - s и h - s). На этих диаграммах (рис. 1. 22) обычно нанесены линии нижней пограничной кривой (x=0), верхней пограничной кривой (х=1), изобары (p=idem), изохоры (v=idem), изотермы (T=idem) и линии постоянной степени сухости (x=idem).
|
|
|
В области влажного насыщенного пара изобары и изотермы совпадают друг с другом, так как 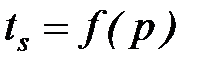 . При переходе в область перегретого пара изобары и изотермы разделяются и каждая представляет собой отдельную кривую. В области влажного насыщенного пара изобары и изотермы изображаются в диаграмме Т- s в виде горизонтальных прямых, а в диаграмме h - s – в виде наклонных прямых.
. При переходе в область перегретого пара изобары и изотермы разделяются и каждая представляет собой отдельную кривую. В области влажного насыщенного пара изобары и изотермы изображаются в диаграмме Т- s в виде горизонтальных прямых, а в диаграмме h - s – в виде наклонных прямых.
Наибольший практический интерес из этих диаграмм имеет диаграмма h - s прежде всего в силу того, что удельная работа ( 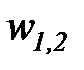 ) в адиабатном процессе, исходя из первого начала термодинамики, по этой диаграмме определяется как величина отрезка между начальными и конечными точками процесса (h1 – h2).
) в адиабатном процессе, исходя из первого начала термодинамики, по этой диаграмме определяется как величина отрезка между начальными и конечными точками процесса (h1 – h2).
В энтропийных диаграммах Т - s и h - s обратимые адиабатные (изоэнтропийные) процессы изображаются вертикальными отрезками.
Диаграмма Т - s, в основном, пользуется для термодинамического анализа различных циклов. Она позволяет по соответствующим площадям определить количество теплоты, подведенного и отведенного к рабочему телу в рассматриваемом цикле и работу цикла. При расчете процессов, в которых имеет место процесс парообразования, а рабочими телами являются различные вещества, преимущественно используется диаграмма h - s.
|
|
|


